大量研究表明,在癌症早期,免疫系统虽能保护机体免受肿瘤发展的影响,但在免疫细胞识别和杀伤肿瘤细胞的过程中,会筛选出免疫原性较低的肿瘤细胞,最终间接促进肿瘤进展。目前,肿瘤细胞逃避免疫监视并发展为恶性肿瘤的具体机制尚不明确,因此亟需深入研究肿瘤免疫逃逸的根本原因,以揭示不同个体的肿瘤遗传特征及细胞表型差异对治疗的影响,从而优化肿瘤免疫治疗策略[1]。
为实现这一目标,研究人员需要建立稳定且能模拟人体肿瘤复杂结构的模型,以开发更有效的抗癌药物或疗法。目前,动物肿瘤模型仍是药物研发和临床前验证的首选工具,其实验数据常被用于预测临床试验的潜在效果。传统的肿瘤异种移植模型(CDX)是将体外培养的肿瘤细胞系注射到免疫缺陷小鼠体内而形成的一种动物模型,CDX模型因其快速、高通量和可重复性等优点,成为抗肿瘤药物临床前药效学评价的重要工具,广泛应用于肿瘤学研究和抗肿瘤药物研发过程中。
肿瘤药效平台新升级“四大亮点”
维通达依托于肿瘤研究平台、专业的技术团队与自主研发的免疫缺陷动物模型(如NPG,HSC-NPG,DK-NPG,F344RG)或常规Balb/c、C57、Balb/c nude等,经过二十多年的沉淀积累了一系列的同源肿瘤移植、异源肿瘤移植以及肿瘤免疫双人源化建立等项目经验。维通达可承担各种CDX/PDX荷瘤、肿瘤药效评价服务(从细胞培养、肿瘤建模、给药、肿瘤测量、活体成像、取材、肿瘤学相关检测分析等一站式)。
(1)荷瘤部位新升级
构建CDX模型时,荷瘤部位更加完善:除了常见的皮下荷瘤、尾静脉荷瘤,目前已拓展至原位移植,包括颅内原位、肝原位、经脾注射、胰腺原位、肾包膜移植、结直肠原位、脂肪垫原位、肺原位等;以及部分肿瘤转移模型。
(2)荷瘤细胞系新升级
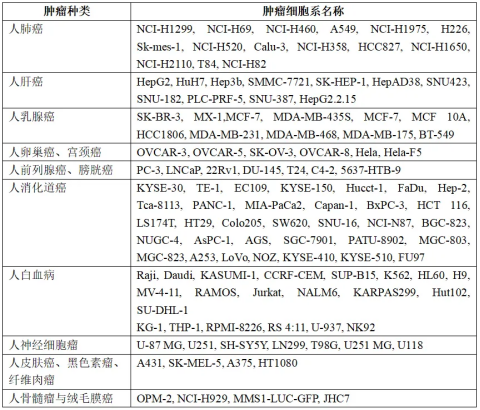
成熟的荷瘤经验已完善:人骨髓瘤、人绒毛膜癌、人皮肤癌、人黑色素瘤、人纤维肉瘤、人神经细胞、人甲状腺癌、人淋巴瘤、人白血病、人肺癌、人肝癌、人乳腺癌、人膀胱癌、人卵巢癌、人宫颈癌、人肾透明细胞腺癌、人前列腺癌、人消化道癌等。具体信息如下:
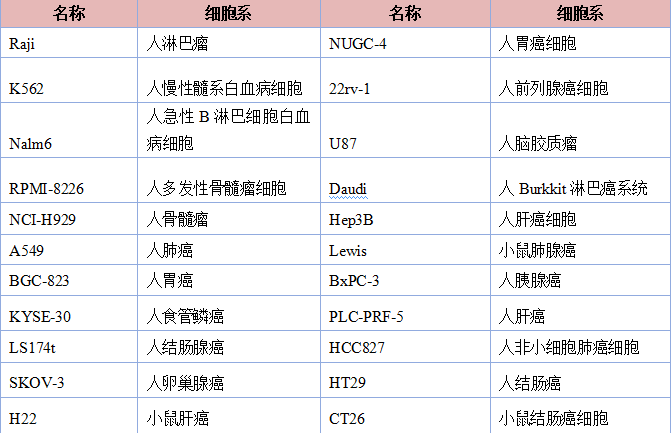
(3)Luciferase标记或荧光蛋白标记的细胞系新升级
(4)荷瘤动物新升级
为了加快CDX或者PDX建库速度,避免NPG、裸鼠等个体小导致的荷瘤体积小、建库传代次数多等劣势。目前为我们在F344RG大鼠已荷瘤人结肠癌、人肺癌、人前列腺人卵巢癌、人脑胶质瘤等,正如预见,荷瘤体积更大,传代次数变少。详情可见微信推文《话差异!高度免疫缺陷大小鼠的成瘤特性》。
1. 同源肿瘤移植:C57BL/6N小鼠颅内原位GL261细胞;
Balb/c nude小鼠颅内原位U87-MG细胞
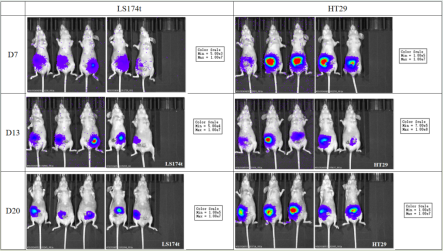
2. 异源肿瘤移植:Balb/c nude小鼠结直肠癌原位(LS174t与HT29细胞系)
3. 异源肿瘤移植:NPG小鼠皮下荷瘤脑胶质瘤(U87细胞系)
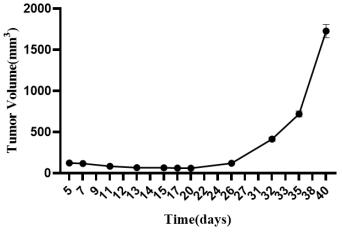
4. 异源肿瘤移植:NPG小鼠皮下荷瘤人乳腺癌(MDA-MB-231细胞系)
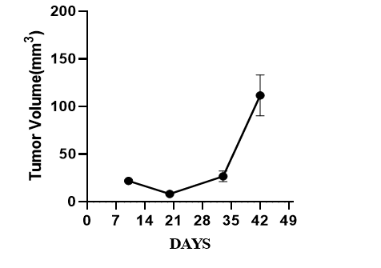
5. 异源肿瘤移植:NPG小鼠皮下荷瘤人肝癌(HepG2细胞系)
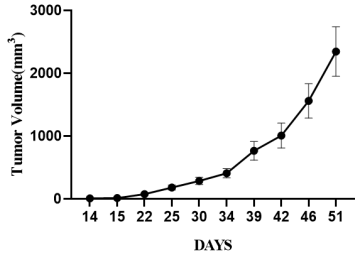
6.异源肿瘤移植:F344RG大鼠右侧腋下接种人卵巢癌(OVCAR3细胞系)
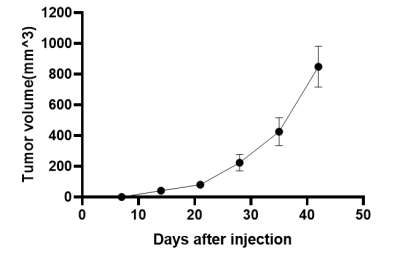
7.同源肿瘤移植:C57小鼠原位接种鼠源脑胶质瘤(GL261细胞系)
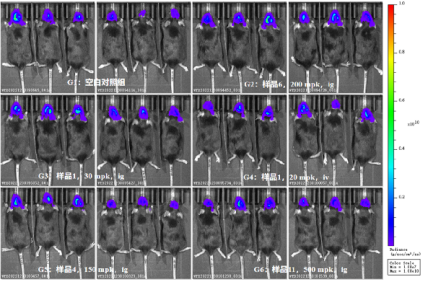
参考文献:
1. 许瀚林,陈建军,赵飞,等.临床前肿瘤模型的建立和应用进展[J].中国新药杂志,2023,32(10):1021-1027.
肿瘤研究 平台优势
维通达致力于为肿瘤研究提供全方位动物模型及体内药效实验服务。
提供的动物模型包括国内首款高度免疫缺陷小鼠NPG和高度免疫缺陷大鼠F344RG、基于NPG及NPG衍生品系构建的人源化免疫系统小鼠HSC及PBMC模型、肿瘤靶点基因人源化小鼠及多种自发肿瘤模型。维通达基于以上动物模型构建了上百种皮下及原位人源肿瘤CDX及PDX模型,目前已完成多个CAR-T,TCR-T, CAR-NK, 溶瘤病毒, 抗体(单抗,双抗,多抗等)等免疫疗法的模型建立及药效评价。
肝病研究 平台优势
维通达肝病服务平台包含传染性肝病(HBV/HDV)药效评价平台及NASH药效评价平台。
维通达乙肝动物模型包含稳定高表达HBV病毒颗粒的HBV-Tg小鼠、腺相关病毒乙肝模型AAV-HBV小鼠以及可以模拟 HBV 自然感染和 cccDNA 复制过程的HBV-Hu-URG模型。维通达拥有可用于HBV研究的生物安全二级设施(ABSL-2),并建立了稳定的HBV检测体系,目前已完成蛋白类药物、siRNA 、核苷类似物、免疫治疗等多种机理药物的乙肝药效评价项目,多个项目成功申报IND。公司也在研发其它肝病相关小鼠模型,如可诱导肝损伤的Tet-uPA小鼠、Fah基因敲除小鼠,以及可用于脂肪肝、肝纤维化、肝硬化研究的基因修饰小鼠LDLR KO和MC4R KO等。