免疫疗法是近年来肿瘤治疗领域的重大突破之一,肿瘤免疫治疗是指通过重新启动或激活人体免疫力,恢复机体正常的抗肿瘤免疫反应,从而控制与清除肿瘤的一种治疗方法。肿瘤免疫疗法包括免疫检查点抑制剂、治疗性抗体、癌症疫苗、细胞治疗和免疫调节小分子药等。其中,免疫检查点抑制剂在多个癌种治疗中展示出强大的抗肿瘤活性,显著改善了多种癌症的预后。从最初的PD-1/PD-L1、CTLA-4、CD3靶点,到如今LAG-3、TIM-3、TIGIT等新兴靶点的不断涌现,免疫疗法的版图正在迅速扩张。
PD1是一种免疫检查点蛋白,主要表达于激活的T细胞和B细胞表面。在肿瘤微环境中,肿瘤细胞通过表达PD-L1与T细胞上的PD-1结合抑制T细胞的活化和增殖,从而逃避免疫系统的攻击。PD-1抑制剂通过阻断这一通路,使T细胞恢复对肿瘤细胞的杀伤能力。
CD3(由γ、δ、ε、ζ和η亚基构成)是T细胞表面的重要标志物,是T细胞受体(TCR)-CD3复合物的关键组成部分,向细胞内传递激活信号,参与T细胞的激活、增殖和分化过程。基于通过CD3激活T细胞的免疫疗法,如单抗和双特异性抗体,能够通过招募T细胞至肿瘤细胞附近或增强 T 细胞的活性来杀伤肿瘤细胞。据药融云全球药物研发数据库显示CD3为TOP5的热点靶点,目前CD3靶点药物临床前后项目超400项。
TIGIT在抑制性免疫检查点中的一个独特性在于它的阻断不仅增强 CD8+T细胞抗肿瘤效应,而且增强NK细胞抗肿瘤反应,并降低调节性T细胞的抑制能力。这使得TIGIT成为一种很有前景的癌症免疫治疗靶点。
TIM-3的主要作用是抑制T细胞的活化、增殖,减少正性调控免疫应答的细胞因子的产生,在抗肿瘤的免疫过程中发挥负性调控作用,使肿瘤细胞发生免疫逃逸,有利于肿瘤在原位点向组织深层侵袭。阻断TIM-3信号也是有潜力的肿瘤免疫治疗策略。
随着基因打靶技术不断发展,维通达将人源免疫检查点靶点基因替换或插入到小鼠的相应基因位点。该靶点基因人源化模型能够表达人源免疫检查点蛋白,更准确地模拟人体免疫系统与肿瘤细胞之间的相互作用,使研究结果更贴近临床实际,而且允许在小鼠模型上直接评价人的药物而不是替代物。
目前,维通达主要针对肿瘤相关热门靶点,已构建hPD-1、hCTLA-4、hLAG-3、hCD3E等基因替换的靶点基因人源化模型,可用于评估免疫检查点抑制剂的抗肿瘤活性;除了肿瘤免疫治疗,科学家也不断探究免疫检查点在自身免疫疾病、感染性疾病、移植免疫学等领域的作用机理和应用,这些小鼠模型也可提供有力工具。
以下主要展示维通达自主研发的在C57背景小鼠建立的
靶点基因人源化模型hPD1与hCD3E小鼠的部分数据~
hPD1抗体(Keytruda)
在hPD1小鼠上抗肿瘤药效验证
1. FACS检测hPD1小鼠脾脏淋巴细胞表达hPD1
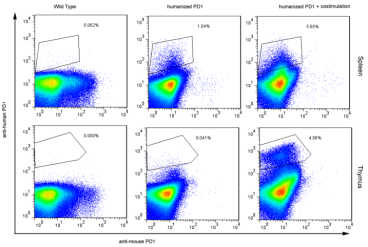
图1. FACS检测hPD1小鼠脾脏淋巴细胞hPD1表达情况
2. hPD1小鼠荷瘤MC38的Keytruda药效验证
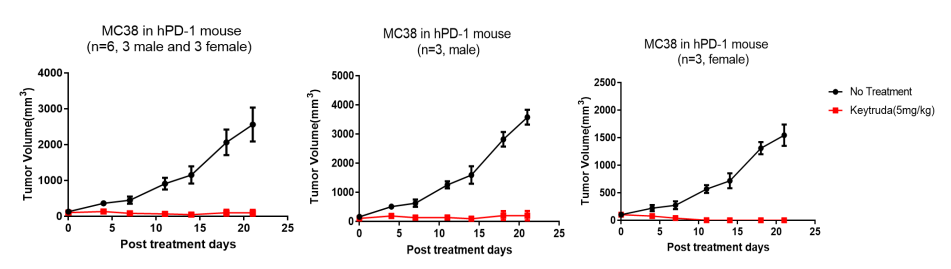
图2. hPD1小鼠荷瘤MC38的Keytruda药效验证
实验设计与结果:hPD-1小鼠皮下接种小鼠MC38结肠癌细胞系,肿瘤生长到100mm3左右时,将动物随机分成2组(n=6,雌雄各半),对照组注射生理盐水,实验组注射Keytruda,每周给药2次,连续给药6次。结果显示,Keytruda在人源化PD-1小鼠上表现出明显的抑瘤效果;雌性和雄性PD-1人源化小鼠均为理想的体内药效试验模型。
3. hPD1小鼠应用场景
(1)PD-1相关的药效或药物筛选实验;
(2)以PD-1为靶点的免疫调节对抗肿瘤、抗感染、抗自身免疫性疾病及器官移植存活等研究。
hCD3E小鼠双特异性抗体药物
抗肿瘤活性验证
1. 流式分析hCD3E小鼠外周血中hCD3E的表达
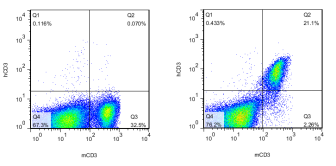
图3. C57BL/6N小鼠 hCD3E小鼠
结果:外周血流式分析可以检测到hCD3E的表达,野生型C57BL/6N小鼠不表达hCD3E,hCD3E小鼠检测到90%的mCD3阳性T细胞表达hCD3E。
2. 流式分析hCD3E小鼠外周血中B、CD4+T、CD8+T和NK细胞的含量
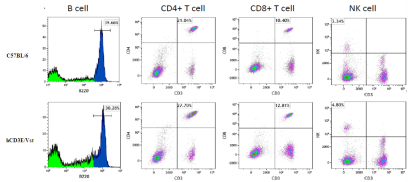
图4. hCD3E小鼠外周血中B、CD4+T、CD8+T和NK细胞的含量
结果:外周血流式分析hCD3E小鼠B、T和NK细胞的分化不受到影响。
3. 分别使用小鼠和人CD3E抗体处理hCD3E小鼠(野生型C57BL/6为对照)后,免疫细胞反应的流式分析
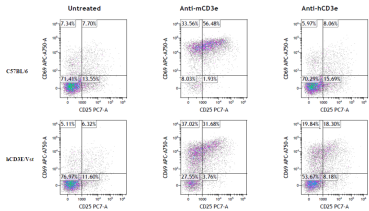
图5. hCD3E小鼠用小鼠和人CD3E抗体处理后外周血免疫细胞反应的流式分析
结果:人CD3E抗体处理,在hCD3E小鼠中可以有效地活化T细胞,野生型C57BL/6小鼠只有抗小鼠的CD3E抗体才能有效激活T细胞。
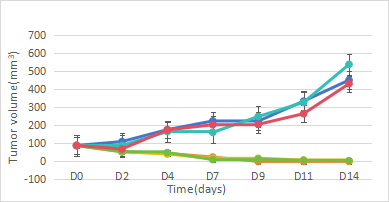
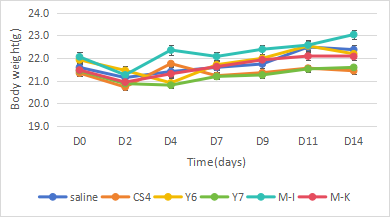
图6. hCD3E小鼠荷瘤CT26-TAA给药双抗后肿瘤体积与体重曲线
实验设计与结果:hCD3E小鼠皮下接种BALB/c小鼠来源的结肠癌细胞系CT26-TAA,肿瘤体积接近100±50mm3时进行分组(n=7),注射5种不同类型的CD3e双特异性抗体药物CS4、Y6、Y7、M-1和M-K,每周2次,连续3周。结果表明:1~2mg/kg hCD3e双特异性抗体CS4、Y6和Y7能够显著抑制肿瘤生长,证明hCD3E小鼠可以有效评估双特异性抗体体内药效。
4. hCD3E小鼠应用场景
(1)验证针对hCD3E和肿瘤抗原的双特异性抗体的抗肿瘤效果;
(2)T细胞发育和活化的研究;
(3)I型糖尿病发病机理和治疗研究。
更多数据与靶点基因人源化模型小鼠模型可联系咨询010-84928167
参考文献:
1. Shinohara T, Taniwaki M, Ishida Y, et al. Structure and chromosomal localization of the human PD-1 gene (PDCD1). Genomics. 1994 Oct;23(3):704-706.
2. Clevers HC, Dunlap S, Wileman TE, et al. Human CD3-epsilon gene contains three miniexons and is transcribed from a non-TATA promoter. Proc Natl Acad Sci U S A. 1988 Nov;85(21):8156-8160.
3. Kuhn C, Rezende RM, da Cunha AP, et al. Mucosal administration of CD3-specific monoclonal antibody inhibits diabetes in NOD mice and in a preclinical mouse model transgenic for the CD3 epsilon chain. J Autoimmun. 2017 Jan;76:115-122.
4. Ueda O, Wada NA, Kinoshita Y, et al. Entire CD3ε, δ, and γ humanized mouse to evaluate human CD3-mediated therapeutics. Sci Rep. 2017 Apr 3;7:45839.
5. https://www.cn-healthcare.com/articlewm/20220623/content-1388170.html.
https://news.qq.com/rain/a/20240112A09BDB00#:
肿瘤研究 平台优势
维通达致力于为肿瘤研究提供全方位动物模型及体内药效实验服务。
提供的动物模型包括国内首款高度免疫缺陷小鼠NPG和高度免疫缺陷大鼠F344RG、基于NPG及NPG衍生品系构建的人源化免疫系统小鼠HSC及PBMC模型、肿瘤靶点基因人源化小鼠及多种自发肿瘤模型。维通达基于以上动物模型构建了上百种皮下及原位人源肿瘤CDX及PDX模型,目前已完成多个CAR-T,TCR-T, CAR-NK, 溶瘤病毒, 抗体(单抗,双抗,多抗等)等免疫疗法的模型建立及药效评价。
肝病研究 平台优势
维通达肝病服务平台包含传染性肝病(HBV/HDV)药效评价平台及NASH药效评价平台。
维通达乙肝动物模型包含稳定高表达HBV病毒颗粒的HBV-Tg小鼠、腺相关病毒乙肝模型AAV-HBV小鼠以及可以模拟 HBV 自然感染和 cccDNA 复制过程的HBV-Hu-URG模型。维通达拥有可用于HBV研究的生物安全二级设施(ABSL-2),并建立了稳定的HBV检测体系,目前已完成蛋白类药物、siRNA 、核苷类似物、免疫治疗等多种机理药物的乙肝药效评价项目,多个项目成功申报IND。公司也在研发其它肝病相关小鼠模型,如可诱导肝损伤的Tet-uPA小鼠、Fah基因敲除小鼠,以及可用于脂肪肝、肝纤维化、肝硬化研究的基因修饰小鼠LDLR KO和MC4R KO等。