基本信息
品系名称 | C57BL/6N -Tg(1.28mer HBV)6 /Vst |
常用名 | HBV-Tg; HBV 转基因小鼠 |
来源 | 北京维通达生物技术有限公司 |
背景 | C57BL/6NCrl |
毛色 | 黑色 |
品系建立
将1.28倍长度的HBV(A 型,GenBank: AF305422.1)线性化片段注入C57BL/6NCrl 小鼠胚胎原核,获得转基因阳性小鼠。通过外周血 HBV 拷贝数分析,保留了拷贝数达到 107-108 IU/mL的首建鼠。按照半合子配野生 C57BL/6NCrl小鼠的方式建立了 HBV 转基因小鼠品系。
该小鼠体内可产生完整的、具有感染性的病毒颗粒,HBV复制水平与慢性乙型肝炎患者相当。除高滴度的HBV DNA,外周血中也可检测到高含量HBsAg、HBeAg。
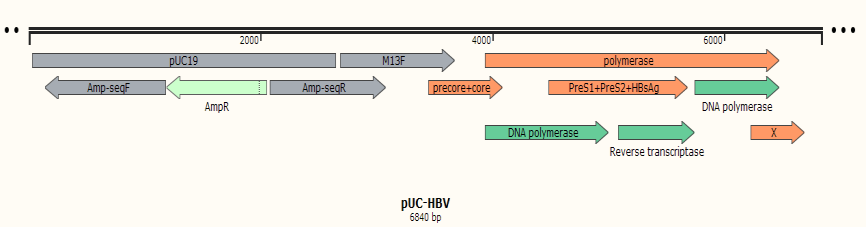
图1. HBV-Tg小鼠策略示意图
基因型鉴定信息
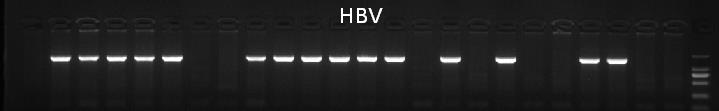
图2. HBV-Tg小鼠基因型鉴定
表型信息
1. 外周血HBV DNA、HBeAg与HBsAg的实时定量PCR检测
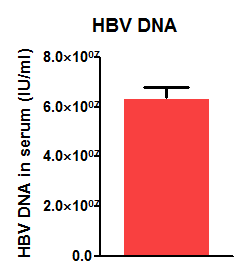
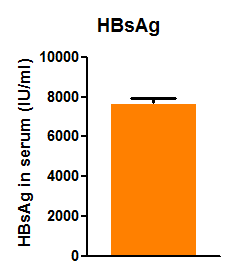
图3. HBV-Tg小鼠外周血HBV DNA、HBeAg与HBsAg含量
2. 不同周龄HBV-Tg小鼠肝组织HBV病毒学检测结果[1]
图4. 血清HBsAg、HBeAg、HBV DNA水平与肝组织HBcAg和HBsAg表达(×200)
注:WT为36周龄野生型雄鼠,Tg 12 w为12周龄HBV-Tg小鼠,Tg 24 w为24周龄HBV Tg小鼠,Tg 36 w为36周龄HBV Tg小鼠
结果表明:通过观察不同周龄的HBV-Tg小鼠,结果显示其HBV病毒学特征稳定。
3. 不同周龄HBV-Tg小鼠肝功能检测及HE染色[1]
图5. 不同周龄的HBV-Tg小鼠肝组织HE染色(×200)
结果表明:HE染色显示,野生型小鼠肝小叶结构完整、清晰,肝细胞索排列整齐,在中央静脉周围呈放射状分布;HBV-Tg小鼠肝组织在12周龄和24周龄时细胞核增大,在36周龄时出现明显的脂肪变性、气球样变、肝细胞索排列紊乱等病理改变。
4. 不同周龄HBV-Tg小鼠肝组织天狼星红染色[1]
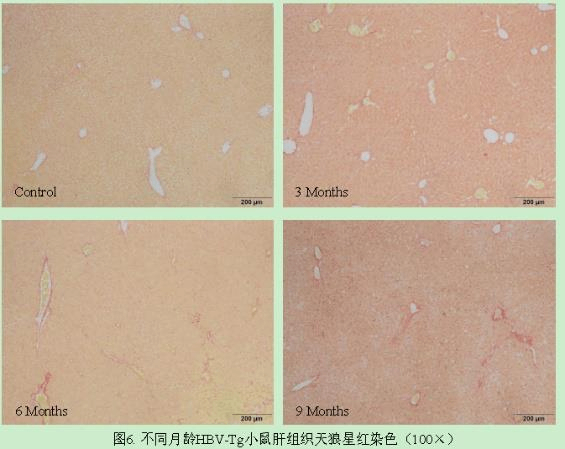
图6. 不同周龄HBV-Tg小鼠肝组织天狼星红染色(×100)
结果表明:6和9月龄HBV小鼠肝组织出现少量胶原沉积,主要集中于汇管区和肝小叶间,未见桥接和假小叶出现。
HBV-Tg小鼠研究实例
1. 多糖物质抗HBV活性研究[2]
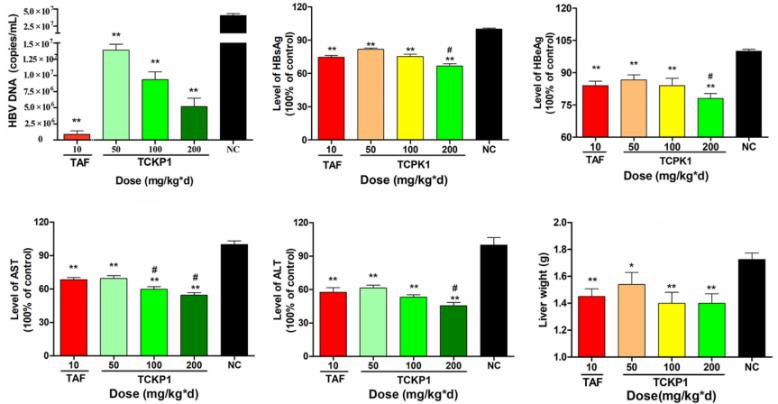
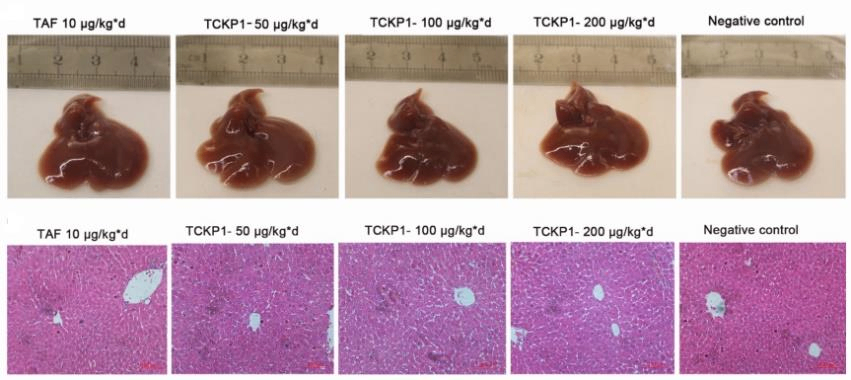
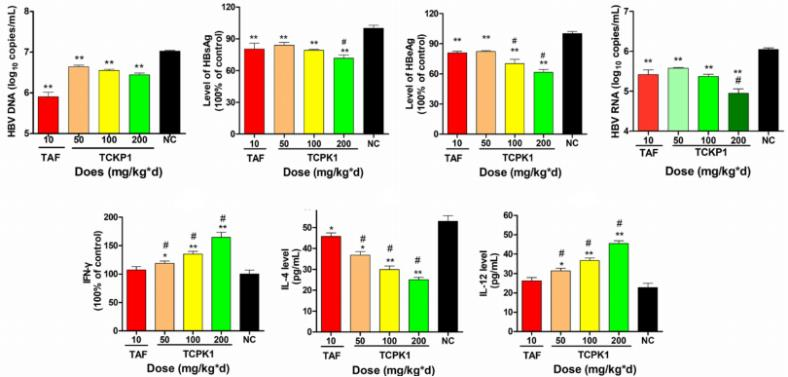
图7. TCKP1的抗HBV活性
25只5周龄SPF级HBV-Tg小鼠随机分为5组,每天腹腔注射10 mg/kg·d TAF (阳性对照组),TCKP1低剂量、中剂量、高剂量组以及阴性对照组(PBS)。给药28天后取血,处死小鼠后取肝脏进行分析。结果表明:与阴性对照组相比,TCKP1显著降低血清HBsAg、HBeAg、HBV DNA、ALT、AST水平以及肝脏中HBsAg、HBeAg、HBV DNA和HBV RNA的水平, 肝脏充血、肿胀均有不同程度改善。同时观察到血清 IL-12、IFN-γ水平升高。这些结果暗示TCKP1的抗HBV作用通过增强免疫细胞功能和调节 Th1/Th2 细胞因子的平衡来实现。
2. HBV出胞调控因子调控研究[3]
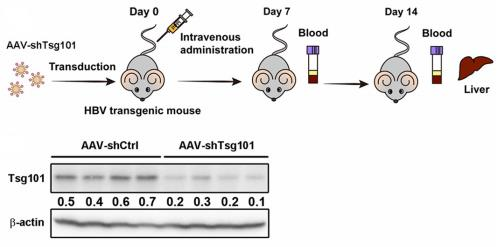
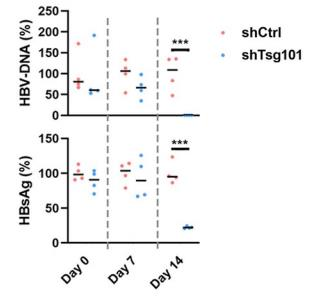
图8. 敲降TSG101对HBV病毒颗粒分泌的影响
8只6-8周龄HBV-Tg小鼠随机分为两组。通过尾静脉注射shRNA或Tsg101靶向shRNA 的重组AAV(×11012病毒基因组)。首次给药后7 d和14 d测定血清HBsAg和HBV DNA水平。在第一次给药后14天测定肝脏中Tsg101的水平。结果表明:TSG101的敲降能够明显抑制 HBV-Tg小鼠血清HBsAg和HBV DNA,证实了TSG101识别泛素化的HBc 蛋白,使HBV利用MVB路径出胞,为抗病毒药物研发提供了新的靶点。
3. 抗HBV新药评价
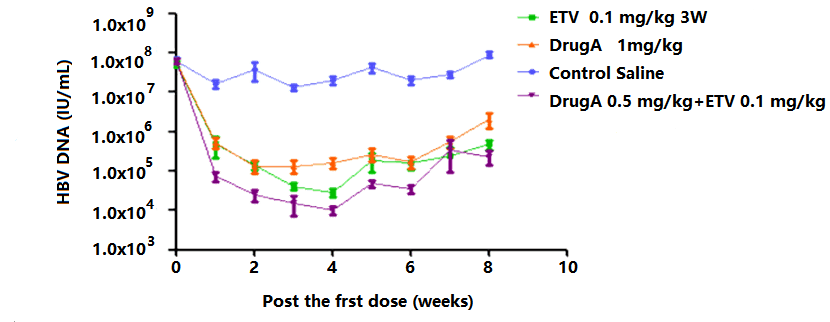
图9. HBV-Tg小鼠不同药物、不同剂量和组合的药效评价
4. CRISPR-Cas9技术治疗乙肝研究[4]
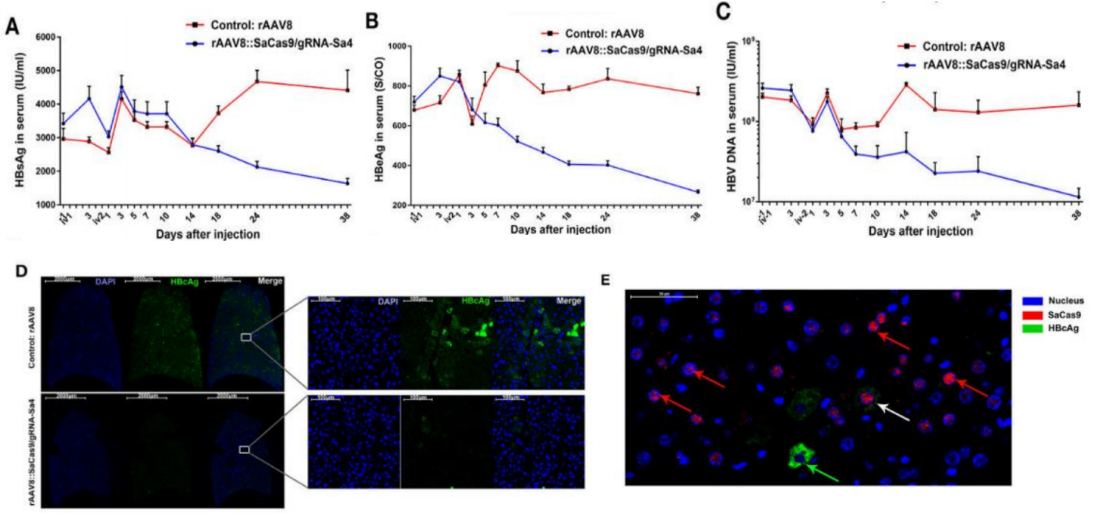
图10. CRISPR-SaCas9对HBV-Tg小鼠HBV抗原表达和HBV复制的抑制作用
14只HBV-Tg小鼠随机分为试验组和对照组(n=7/group),第一次给药后第3天,第二次给药后第1、3、5、7、10、14、18、24、38、53天分别从小鼠眼静脉抽血。在第二次注射后第39天,各组随机选取3只小鼠,解剖取心、肝、脾、肺、肾,制备组织切片进行观察。结果表明:随着时间的推移,试验组小鼠血清中HBV标志物水平持续下降,肝组织 HBcAg染色的荧光强度较低,说明可有效抑制小鼠肝细胞中HBcAg的表达。
HBV-Tg小鼠应用领域
1. 该模型可用于研究HBV、治疗药物和疫苗及更下游的慢性肝炎和纤维化(结合化学诱导)。
2. 为研究病毒和宿主因素影响HBV复制、发病基因和生理学过程提供了稳定遗传的模型
参考文献
1. 孙鑫,等. C57BL/6N-Tg(1.28HBV)/Vst 乙肝病毒转基因小鼠肝脏炎症与纤维化的病理特点. 肝脏, 2018, 23(01):26-30.
2. Tang F, et al. Anti-HBV Activities of Polysaccharides from Thais clavigera (Küster) by In Vitro and In Vivo Study. Mar Drugs. 2021, 19(4):195.
3. Zheng Y, et al. Hepatitis B virus hijacks TSG101 to facilitate egress via multiple vesicle bodies. PLoS Pathog. 2023, 19(5):e1011382.
4. Li H, et al. Inhibition of HBV Expression in HBV Transgenic Mice Using AAV-Delivered CRISPR-SaCas9. Front Immunol. 2018, 9:2080.