基本信息
品系名称 | Hu-HSC-NPG |
来源 | 北京维通达生物技术有限公司 |
背景 | NPG |
毛色 | 白色 |
品系建立
Hu-HSC-NPG即辐照清髓的NPG小鼠移植来自人的脐带血、胎肝的造血干细胞(HSC)的模型。造血干细胞是所有造血和免疫细胞的共同祖细胞。HSC 移植 NPG 类高度免疫缺陷小鼠之后可以定植于小鼠骨髓,并不断产生各类造血、免疫细胞,如 T 细胞、B 细胞、NK 细胞、髓系细胞等。并且由于其免疫细胞是在小鼠体内“从头”发育出的,对小鼠宿主产生耐受,所以一般不出现GvHD现象(30周以后少部分会出现GVHD),研究窗口期可达一年。具体构建方式如下:
高度免疫缺陷小鼠NPG经射线亚致死性辐照,破坏小鼠自体骨髓造血功能,再通过静脉注射、骨髓腔内注射或新生鼠肝内注射等途径移植人脐带血、骨髓、胎肝等来源的造血干细胞,12周以后采血检测人源各系血细胞的重建,确定血液中人/鼠细胞的嵌合比率。 如图所示。

图1. Hu-HSC-NPG策略示意图
表型信息
1. 生存率
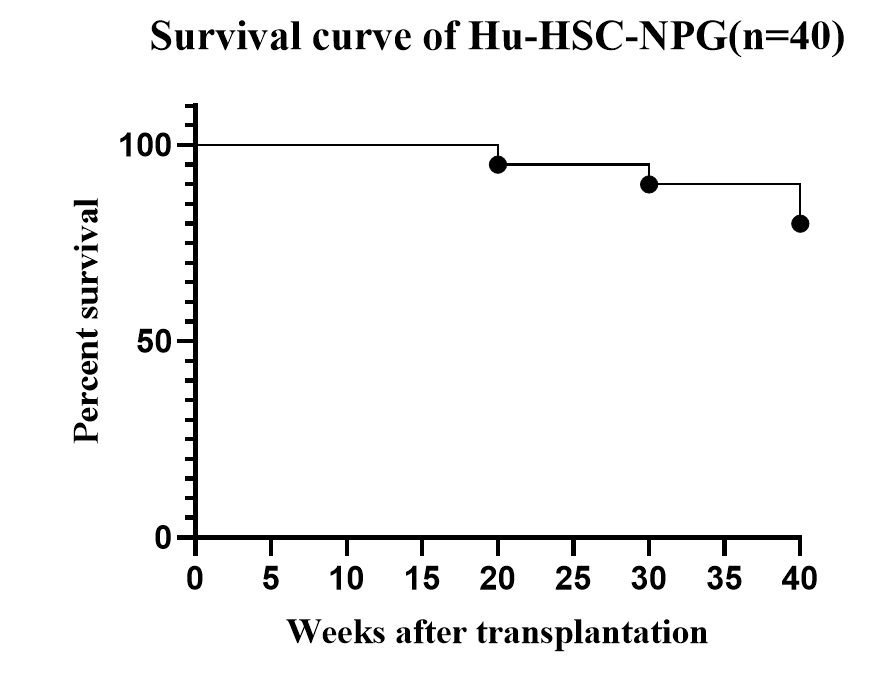
图2. Hu-HSC-NPG小鼠生长曲线
长期观测Hu-HSC-NPG小鼠生存状态,其存活时间可超过40周,并且由于其免疫细胞是在小鼠体内“从头”发育出的,对小鼠宿主产生耐受,所以一般不出现GvHD现象(30周以后少部分会出现GVHD),研究窗口期可达一年。
2. 免疫细胞重建水平
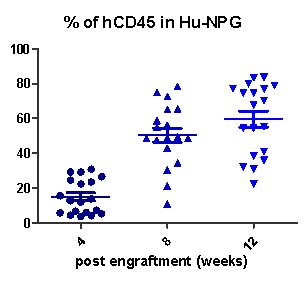
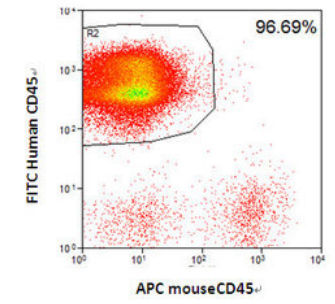
图3. HSC移植NPG小鼠高水平重建造血系统
采集不同重建周期的Hu-HSC-NPG外周血经流式分析,5×104脐带血CD34+细胞移植入NPG后随着重建周期增加hCD45+水平不断提高(左图);1×105脐带血CD34+细胞移植后16周在NPG小鼠脾脏中可检测到高水平的hCD45+细胞(右图)。
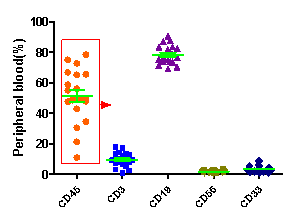
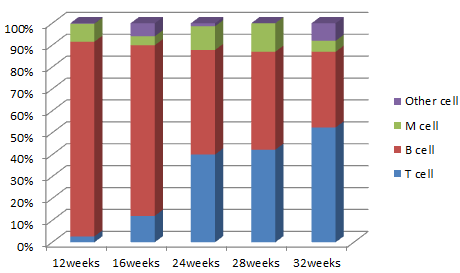
图4. HSC移植NPG小鼠不同重建周期免疫细胞分化水平
采集不同重建周期的Hu-HSC-NPG外周血经流式分析,5×104脐带血CD34+细胞移植12周后在NPG小鼠外周血中检测到高hCD45+白细胞重建,同时检测到分化的主要为hCD19+ B细胞以及CD3+ T细胞和CD33+髓系细胞(左图);随着重建周期越来越长,T细胞所占比例越来越高。
3. 原位成瘤
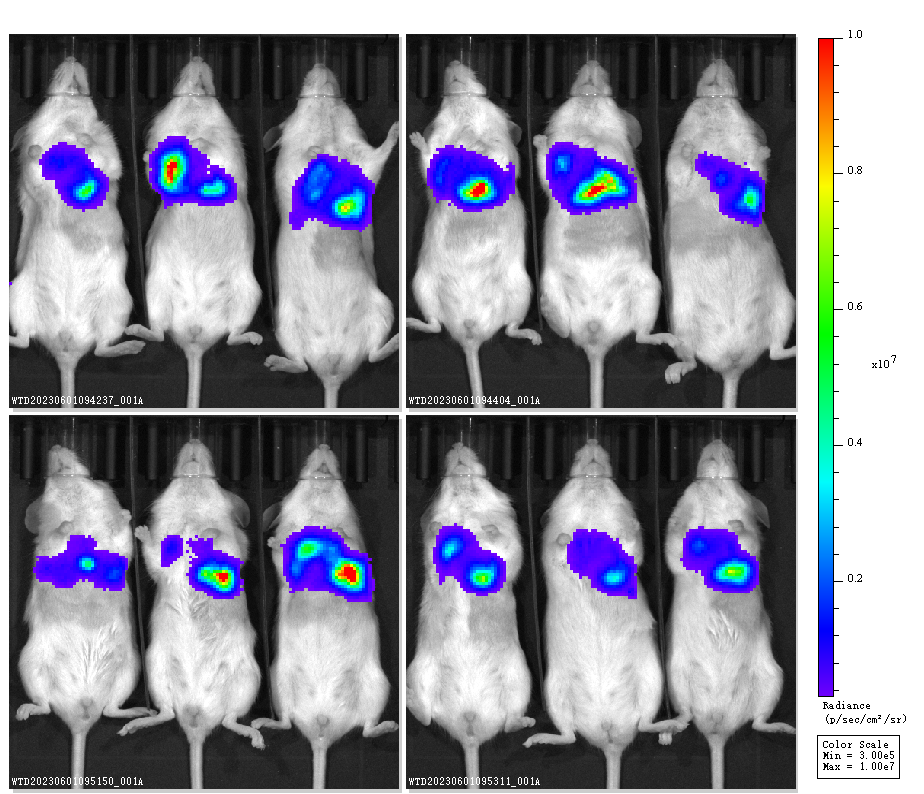
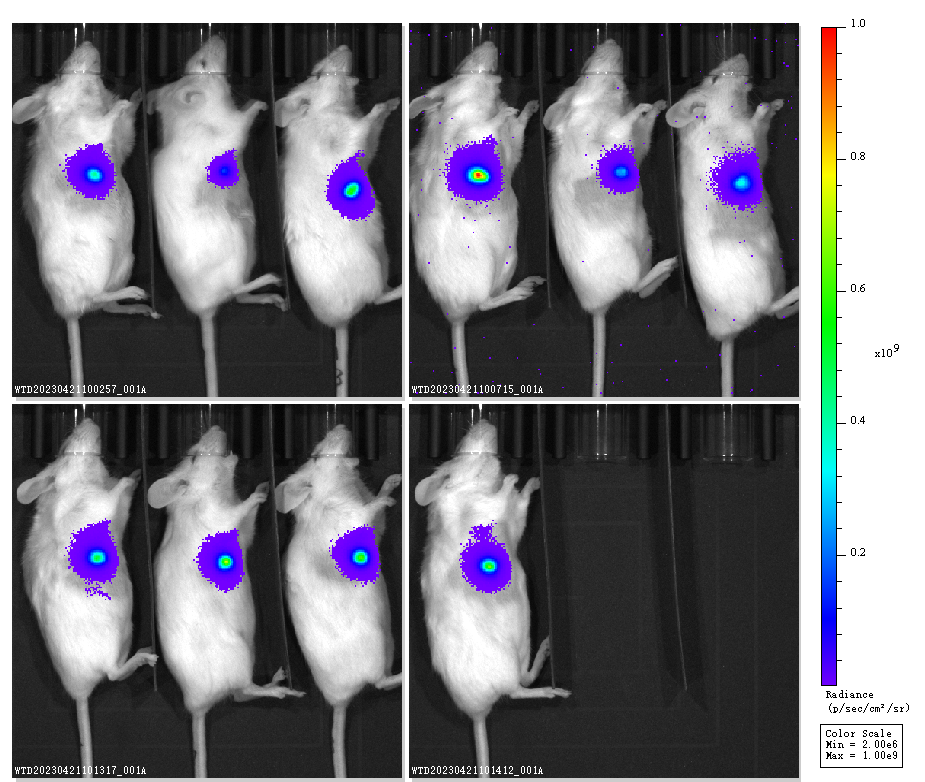
图4. Hu-HSC-NPG小鼠原位成瘤
Hu-HSC-NPG小鼠不同肿瘤造模及药效研究实例
1. 不同异种肿瘤移植模型及抗体类药物药效评价
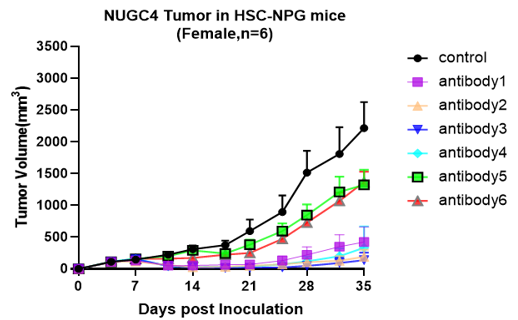
A B
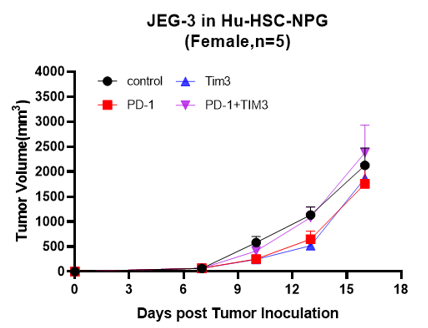
C D
图5. 细胞系移植成瘤情况及不同药物抗肿瘤作用
注:A为人结肠癌细胞系,B为人胃癌细胞系,C为人绒毛膜癌,D为人脑胶质瘤
2. 不同异种肿瘤移植模型及PD1/PDL-1抑制剂药效评价
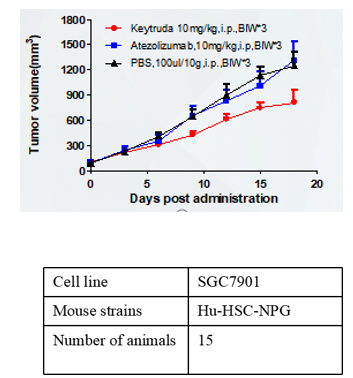
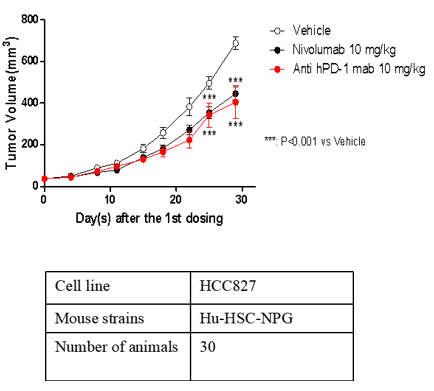
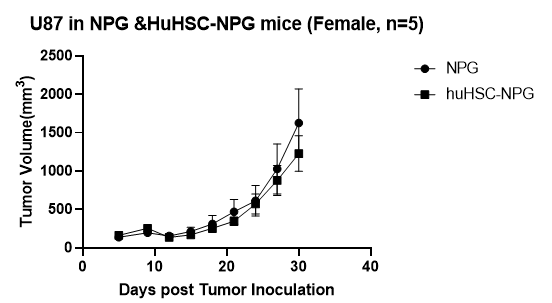
A B
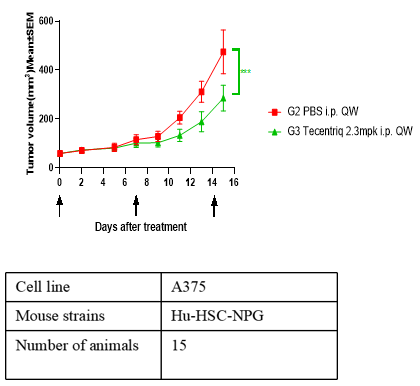
C
图6. 细胞系移植成瘤情况及不同药物抗肿瘤作用
注:A为人胃癌细胞系,B为人非小细胞肺癌细胞系,C为人恶性黑细胞色素瘤
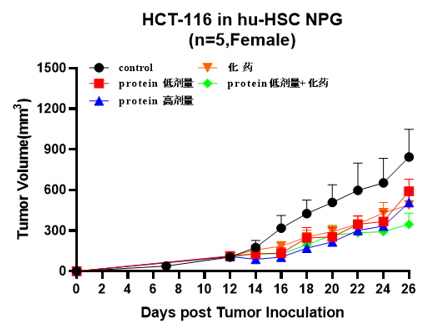
3. 构建人胃癌模型及胃癌间充质干细胞联合PD-1抗体药体内药效[1]
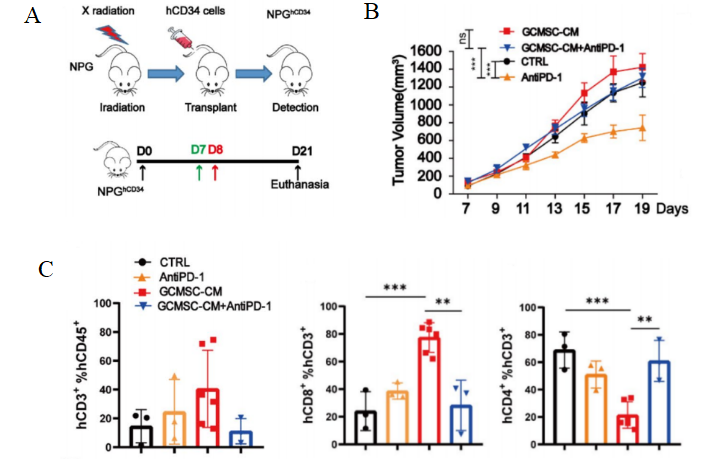
图7. Hu-HSC-NPG接种胃癌肿瘤后肿瘤及肿瘤组织免疫细胞水平
4-8周龄NPG小鼠经X射线(1.2 Gy)照射后24 h内静脉注射5×104人脐带血CD34+细胞。重建12周之后接种患者胃癌肿瘤细胞系,并分别或联合使用GCMSC-CM和PD-1抗体治疗并观测肿瘤变化,并检测不同处理组肿瘤组织中CD45+CD3+, CD3+CD8+, CD3+CD4+含量。结果表明:在治疗后21天,PD-1抗体治疗显著抑制胃肿瘤生长,而GCMSC-CM联合PD-1抗体比单独使用PD-1抗体治疗显著增加肿瘤体积,说明GCMSC-CM消除了PD-1抗体对胃肿瘤生长的抑制作用。
4. 构建人淋巴瘤模型及小分子抑制剂疗法药效[2]
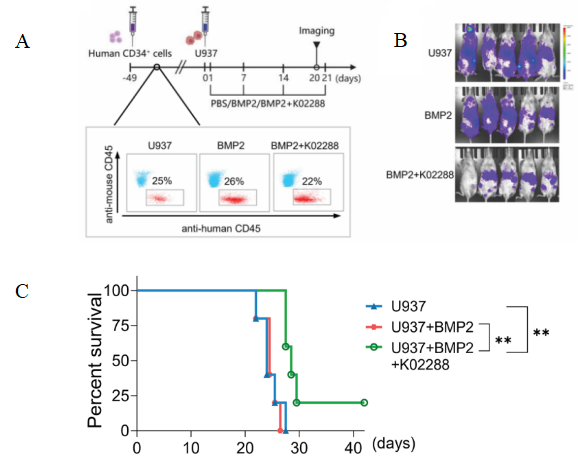
图8. Hu-HSC-NPG接种U937细胞系构建示意图及抗肿瘤效果
5-6周龄雌性NPG小鼠(n=5 per group)辐照(1 Gy)清髓之后尾静脉注射5×105人CD34+细胞,6-7周后外周血检测anti-mouse CD45 and anti-human CD45抗体。小鼠外周血单个核细胞中人CD45+细胞的比例> 20%,证实人白细胞移植成功。如图所示注射U937(人组织细胞淋巴瘤细胞)与BMP2或BMP2与k02288。目的是通过小分子抑制剂抑制BMP2信号途径阻碍Reg-Vδ2 T细胞的肿瘤生长效果。结果表明:K02288联合BMP2处理则明显抑制了U937细胞的生长并显著延长生存期。
5. 双抗药物的毒理学评价[3]
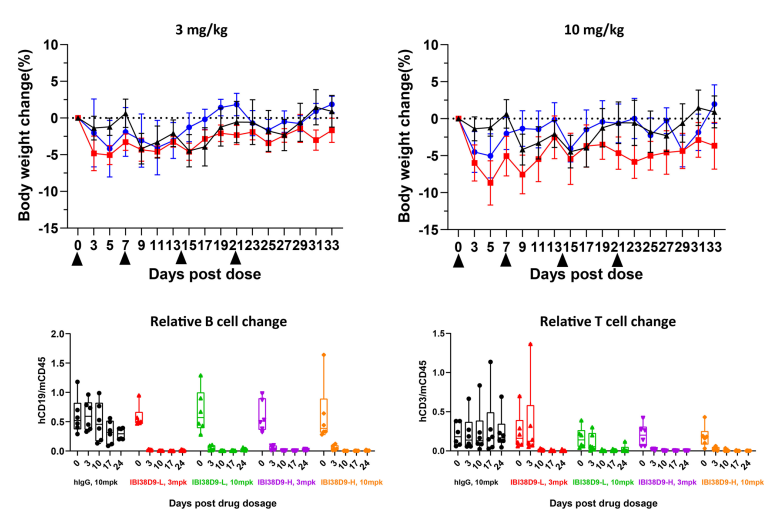

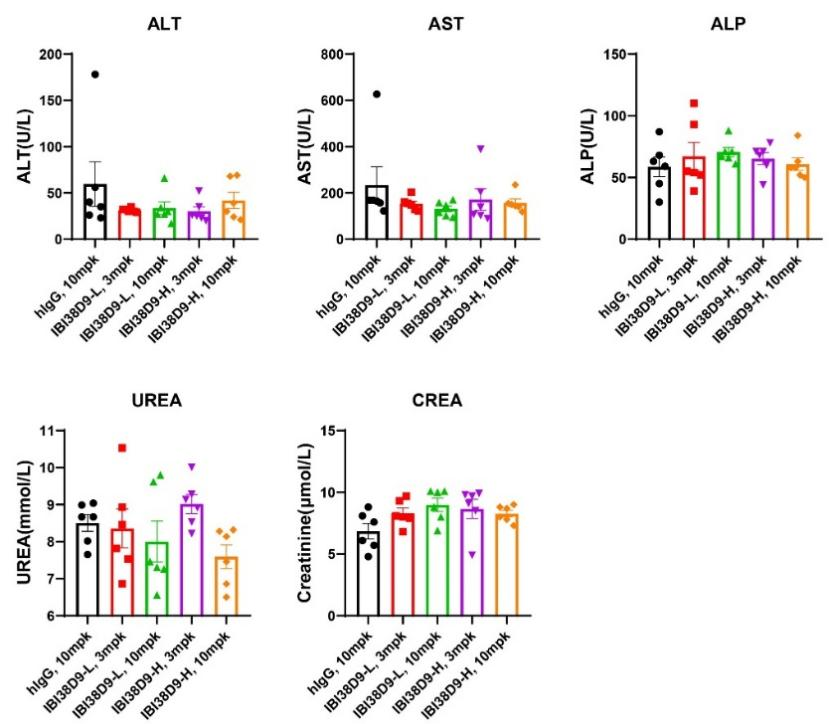
图9. IBI38D9双抗药物用于HSC-NPG小鼠临床前毒理学评价
根据外周T细胞和B细胞组成将小鼠随机分为五组(n=7 per group),并在第0、7、14和21天用人IgG(10mg/kg)、IBI38D9-L(3mg/kg和10mg/kg)或IBI38D8-H(3mg/kg或10mg/kg)处理。每隔一天测量体重并在给药6小时后采集血液用于测定细胞因子与PD参数。在第35天对小鼠实施安乐死,并使用全血或血清进行血细胞或血液生化参数分析。结果表明:在给予IBI38D9-L双抗后观察到小鼠体内人源B细胞的清除和T细胞的消耗,证明IBI38D9-L双抗通过偶联、激活T细胞有效杀伤CD79b阳性细胞的作用。实验中观察到小鼠模型体重的轻微减轻和轻度的因子释放风暴现象,表明Hu-HSC-NPG模型可以在一定程度上反映此类双抗药物的毒理效应,为药物临床试验提供重要参考。
6. 感染HIV模型应用于基因敲除治疗研究[4]
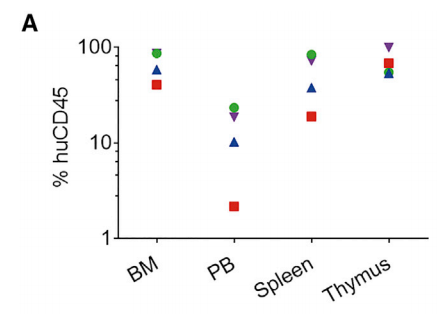
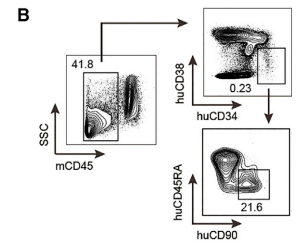
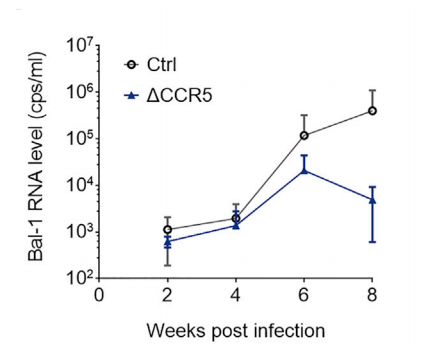
图10. Hu-HSC-NPG二次移植小鼠重建12周后各器官huCD45的比例和HIV感染后Bal-1 RNA水平
新生NPG小鼠进行亚致死照射(1.0 Gy),并移植经过CCR5基因敲除的1×106 hCD34造血干祖细胞,重建12周后采集骨髓细胞进行二次移植。4只6-8周龄NPG小进行亚致死照射(1.6 Gy),并移植三分之一的骨髓CD34细胞。重建12周后检测骨髓、外周血、脾脏和胸腺细胞中huCD45比例,骨髓中检测人CD34+/38-/45RA-/90+ HSPCs。进一步用腹腔注射HIV毒株进行攻毒试验每两周检测HIV Bal-1 RNA水平,8周后对小鼠进行安乐死。结果表明:二次移植HSC-NPG小鼠在骨髓、外周血、脾脏和胸腺中检测到高水平huCD45细胞。同时,敲除CCR5基因的HSC-NPG组HIV RNA水平降低,此研究为将CCR5基因编辑的HSC移植用于临床HIV治疗提供了证据。
Hu-HSC-NPG小鼠应用领域
1. 人源细胞或组织移植(如人结肠癌组织)
2. 肿瘤和肿瘤干细胞研究(如人淋巴瘤,人胰腺癌)
3. ES和iPS细胞研究
4. 造血和免疫学研究
5. 人类疾病感染模型研究(如HIV、HIV、EB、CMV等病毒感染感染)
6. 人源化动物模型研发
7. 免疫检查点(ICI)等免疫调节性药物评价
8. 双特异性抗体(BiTE)等靶向T细胞的抗体药物肿瘤药效评价
9. 肿瘤免疫微环境研究
10. 细胞因子释放风暴(CRS)模型
参考文献
1. Huang C, et al. Gastric cancer mesenchymal stem cells via the CXCR2/HK2/PD-L1 pathway mediate immunosuppression. Gastric Cancer. 2023, 26(5):691-707.
2. Liang S, et al. Identification of the immunosuppressive effect of γδ T cells correlated to bone morphogenetic protein 2 in acute myeloid leukemia. Front Immunol. 2022, 13:1009709.
3. Wang J, et al. Characterization of anti‑CD79b/CD3 bispecific antibody, a potential therapy for B cell malignancies. Cancer Immunol, Immunother 2023; 72:493–507.
4. Xu L, et al. CRISPR/Cas9-Mediated CCR5 Ablation in Human Hematopoietic Stem/Progenitor Cells Confers HIV-1 Resistance In Vivo. Mol Ther. 2017, 25(8):1782-1789.