基本信息
品系名称 | Hu-PBMC-DK-NPG |
来源 | 北京维通达生物技术有限公司 |
背景 | NPG |
毛色 | 白色 |
品系建立
DK-NPG小鼠结合了严重联合免疫缺陷突变(scid)、Il2rγ基因敲除特点,具有高度免疫缺陷特性。为了减缓GvHD反应,延长实验窗口期,维通达基于CRISPR-Cas9 技术,将NPG小鼠17号染色体的IA、H2D(MHC I类分子)和H2K基因(MHC II类分子)全部删除,获得 MHC I/II双敲除小鼠(DK-NPG)。
考虑到 GvHD 主要由 MHC I 类和 II 类分子介导,而且 I 类分子表达更广泛,因此DK-NPG敲除了以及MHC II 类分子,使得移植Hu-PBMC 或分离的T细胞等免疫细胞后,无法识别小鼠细胞表面的MHC,减轻免疫攻击,减缓 GvHD 的发生。
表型信息
1. 人源PBMC在DK-NPG小鼠的重建效果
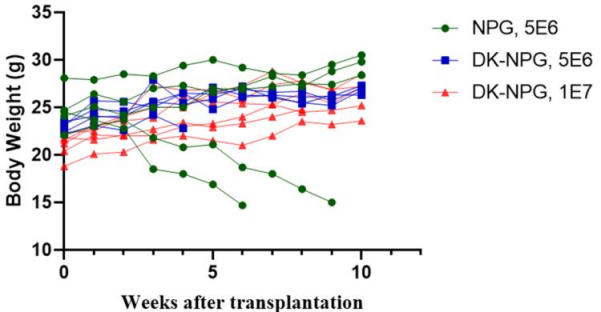
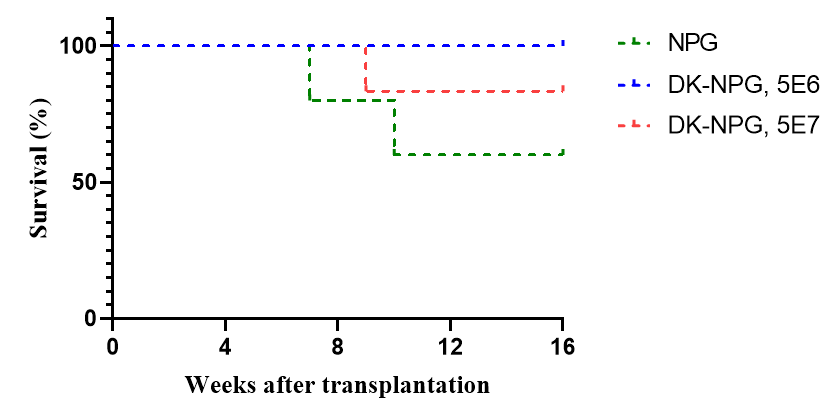

图1. NPG与DK-NPG小鼠接种Hu-PBMC (5×106与1×107 cells/mouse)后的生存率、体重曲线及GVHD评分
注:GVHD 评分时每组5只小鼠,数据展示为各组评分均值(Mean)
NPG与DK-NPG移植Hu-PBMC细胞后,与NPG小鼠相比,DK-NPG小鼠的生存周期更长,体重稳步增长且表现出的 GVHD 症状更轻(体重、活动能力、姿势、毛发和皮肤完整性等)。
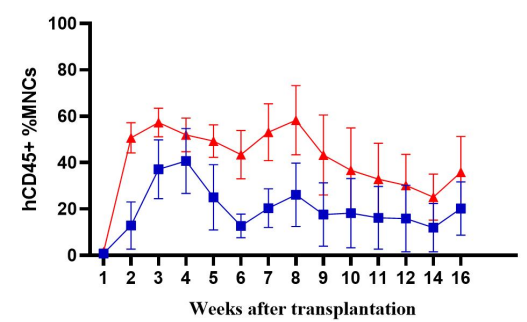
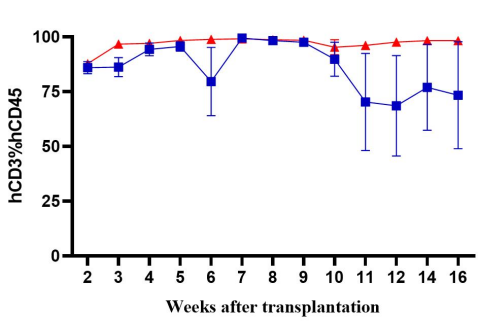
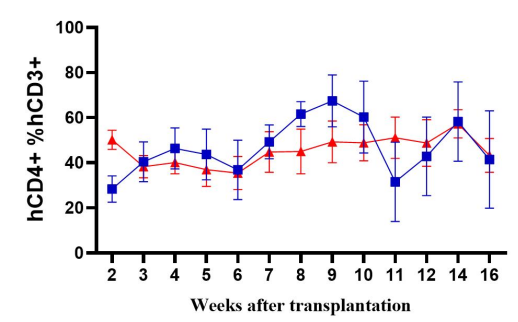
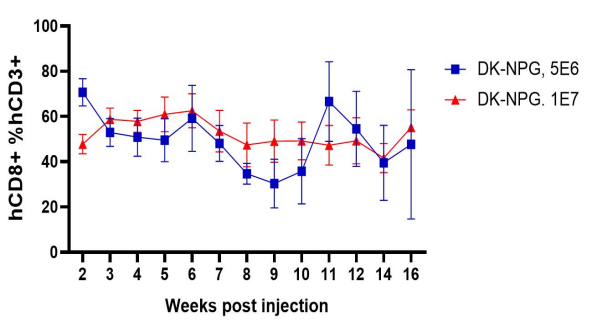
图2. NPG与DK-NPG小鼠接种Hu-PBMC后免疫细胞重建效率
DK-NPG在接种不同剂量Hu-PBMC后很好地重建人类免疫系统,且趋势基本一致,表明 DK-NPG 模型稳定性与重建效率相当高。其中接种1E7 Hu-PBMC后重建效率最高可达60%左右,实验窗口期可达14周;主要重建的细胞为人的CD3 T细胞,主要分化的hCD3 T细胞群为hCD4与hCD8,其中 hCD4 细胞呈上升趋势,hCD8 细胞呈下降趋势。该模型可用于评估不同CD3 T细胞亚群的功能,探索其在 GvHD 发展中的作用。
2. 不同Donor来源的PBMC在DK-NPG小鼠的重建效果
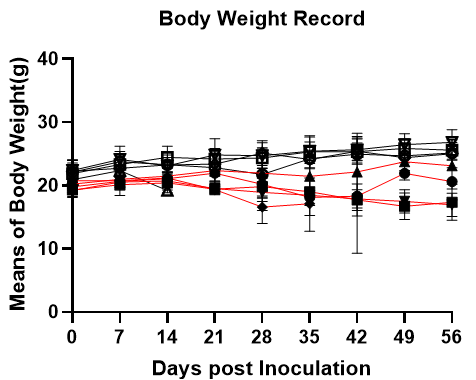
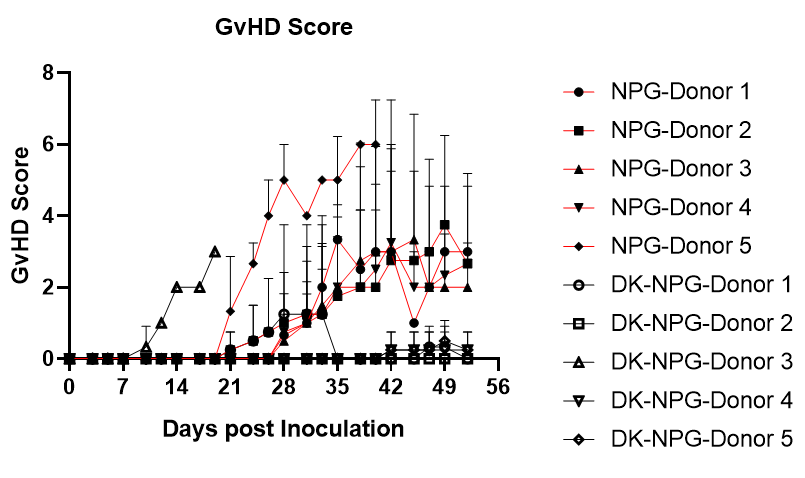
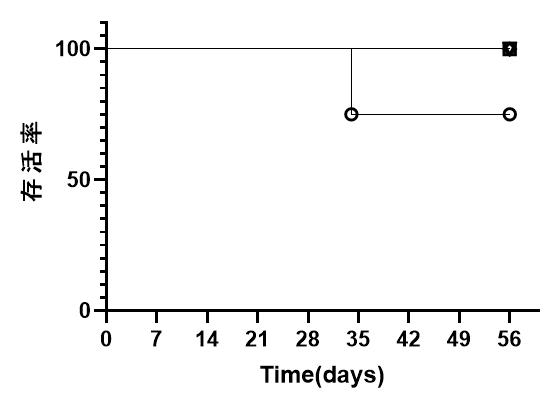
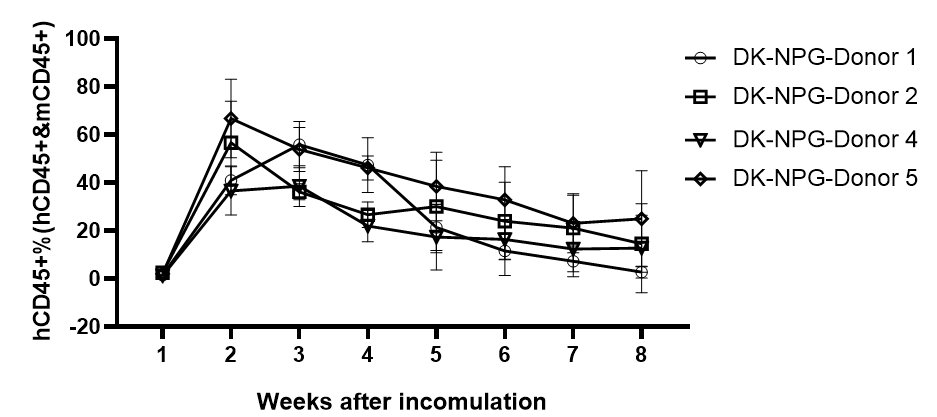
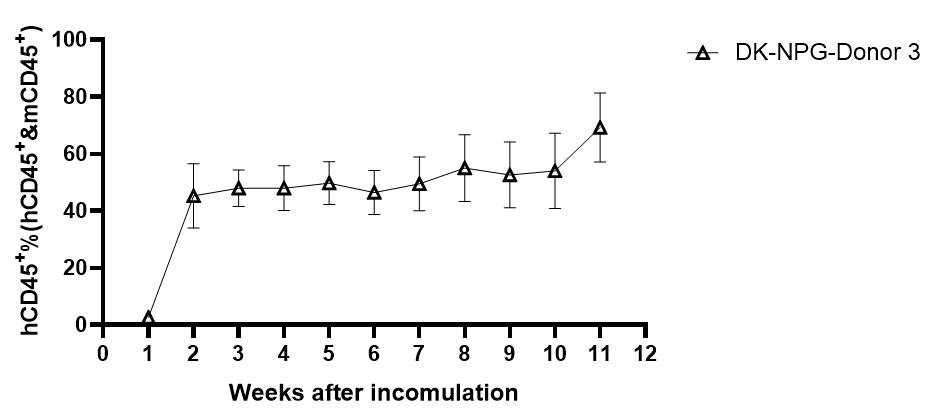
图2. NPG与DK-NPG小鼠接种不同Donor来源Hu-PBMC后免疫细胞重建效率与生存情况
DK-NPG与NPG接种不同Donor来源不同剂量的Hu-PBMC,在同一种小鼠身上不同Donor的有差异,HuPBMC-DK-NPG比PBMC-NPG的体重更加稳定、GVHD程度变弱与GVHD反应发生时间推迟。
HuPBMC-DK-NPG小鼠不同肿瘤造模及药效研究实例
1. 构建人恶性黑色素瘤模型及PD-1抗体药治疗效果
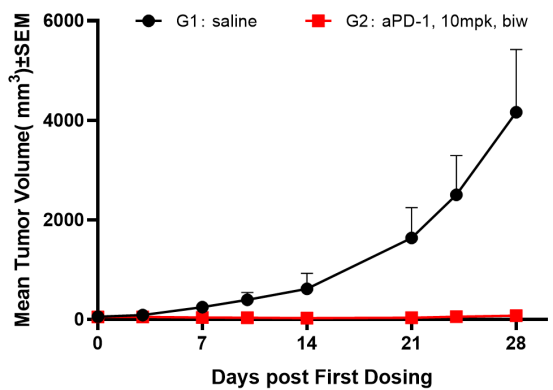
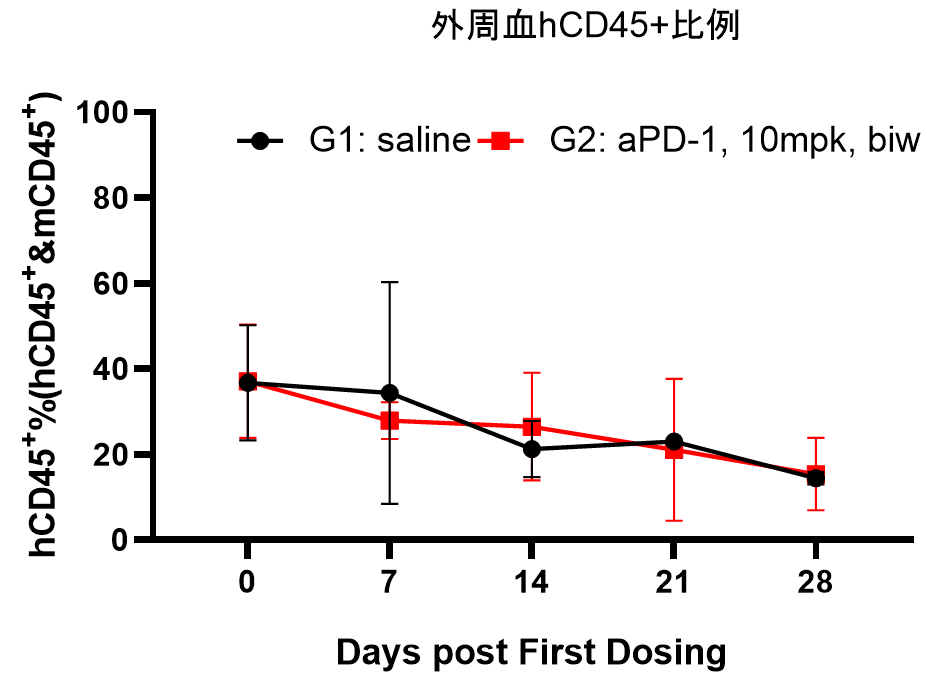
图3. PD-1抗体药在Hu-PBMC重建后的DK-NPG小鼠中药效评价
5-6周龄雌性NPG小鼠接种人PBMC,重建一周后皮下接种A-375人恶性黑色素瘤细胞,当肿瘤生长到约100-200 mm3时,将小鼠随机分2组(n=6 per group)并进行aPD-1抗体给药,持续监测hCD45+的水平。结果发现aPD-1抗体可以显著抑制DK-NPG小鼠体内的A-375肿瘤生长。
2. 构建人宫颈癌模型及PD-1抗体药治疗效果
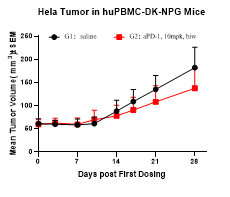

图5. PD-1抗体药在Hu-PBMC重建后的DK-NPG小鼠中药效评价
5-6周龄雌性NPG小鼠接种人PBMC,重建一周后皮下接种Hela人宫颈癌细胞,当肿瘤生长到约60-80 mm3时,将小鼠随机分2组(n=6 per group)并进行aPD-1抗体给药,持续监测hCD45+的水平。结果发现aPD-1抗体对DK-NPG小鼠体内的Hela肿瘤生长有一定的抑制作用。
HuPBMC-DK-NPG小鼠应用领域
1. 异源移植GVHD体内机理研究
2. 研究CD3 T细胞及分化的CD3 T细胞亚群的激活、增殖和功能,探索其在GvHD发展中的作用
3. 药效学评价,研究多种靶点在CD3 T细胞的肿瘤免疫药物、CAR-T、TCR-T、小分子抑制剂、免疫检查点阻断(ICB)与分子靶向药物的新型联合使用研发与评估抗体药物的疗效和安全性评价
4. 评估治疗相关的细胞因子释放综合征,并评估细胞治疗的长期毒性相关研究
5. 新的人源化动物模型研发
参考文献
1. Ashizawa T, et al. Antitumor Effect of Programmed Death-1 (PD-1) Blockade in Humanized the NOG-MHC Double Knockout Mouse. Clin Cancer Res. 2017, 23(1):149-158.
2. Ashizawa T, et al. Impact of combination therapy with anti-PD-1 blockade and a STAT3 inhibitor on the tumor-infiltrating lymphocyte status. Immunol Lett. 2019, 216:43-50.
3. Santi Suryani Chen, et al. NCG-MHC-dKO mice - an excellent model for PBMC reconstitution and pharmacodynamic evaluation in the absence of GvHD. J Immunol. 2023, 210 (1_Supplement): 89.22.
4. Covassin L, et al. Human immune system development and survival of non-obese diabetic (NOD)-scid IL2rγ(null) (NSG) mice engrafted with human thymus and autologous haematopoietic stem cells. Clin Exp Immunol. 2013, 174(3):372-388.
5. Brehm MA, et al. Lack of acute xenogeneic graft- versus-host disease, but retention of T-cell function following engraftment of human peripheral blood mononuclear cells in NSG mice deficient in MHC class I and II expression. FASEB J. 2019, 33(3):3137-3151.