基本信息
品系名称 | NOD.Cg-Prkdcscid Il2rgtm1/Vst |
常用名 | NPG小鼠 |
来源 | 北京维通达生物技术有限公司 |
背景 | NOD |
毛色 | 白色 |
基因编辑技术 | ES细胞打靶 |
编辑基因 | Il2rg |
品系建立
NPG小鼠是北京维通达生物技术有限公司自主研发的重度免疫缺陷小鼠。构建详情如下:
首先进行ES细胞打靶:构建Il2rg基因打靶载体,在B6/129 F1背景的ES细胞上,筛选Il2rg基因3-8号外显子被替换为pGK-neo抗性序列的阳性打靶细胞(见图1)。再通过囊胚注射的方法,获得Il2rg基因敲除的ES嵌合小鼠,即首建鼠。将首建鼠与NOD-scid小鼠回交,筛选的阳性后代与NOD-scid小鼠回交。通过12代的回交,选择Il2rg-雄鼠和Il2rg+/-雌鼠交配,最终获得PrkdcscidIl2rg-/-小鼠。随后,NOD.PrkdcscidIl2rg-/-小鼠按照近交系的方式扩繁生产。
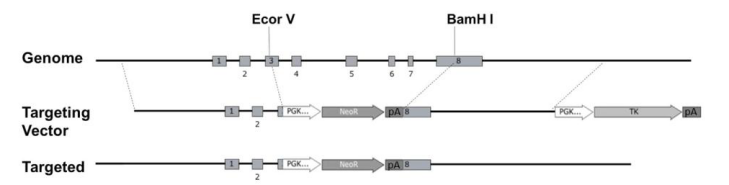
图1. Il2rg基因打靶策略示意图
基因型鉴定信息

图2. Prkdc基因PCR检测 图3. Il2rg基因PCR检测
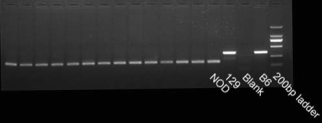
图4. NOD背景(Sirpa基因)检测
表型信息
1. 生长曲线
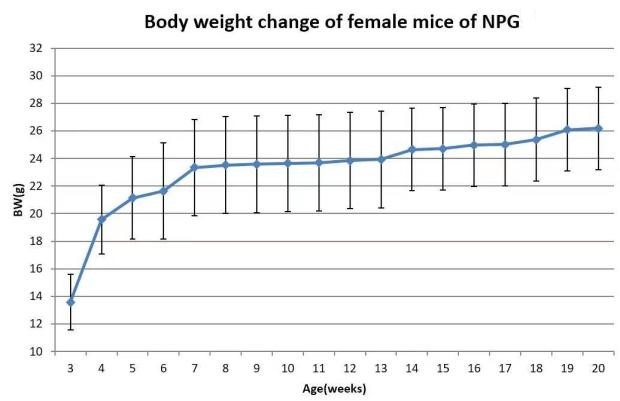
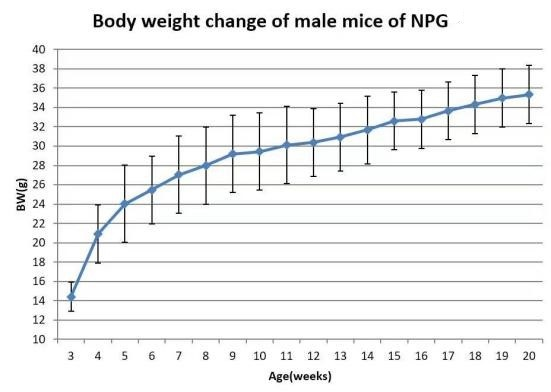
图5. NPG小鼠生长曲线
2. 血生化分析
表1. 8周龄NPG雌鼠血液生化分析
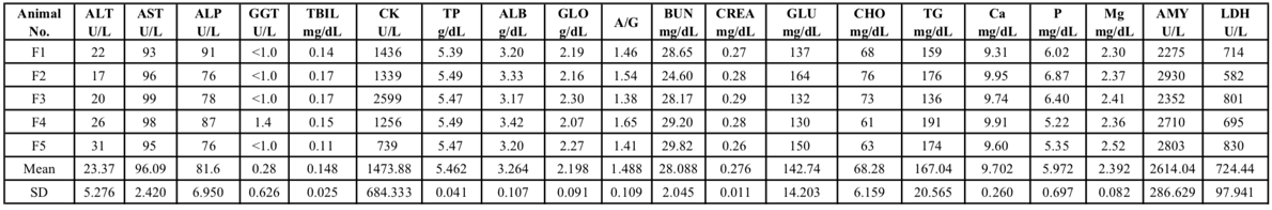
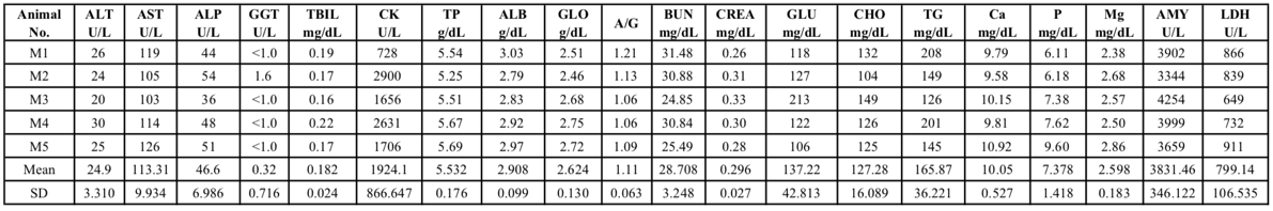
表2. 8周龄NPG雄鼠血液生化分析
3. 免疫细胞检测
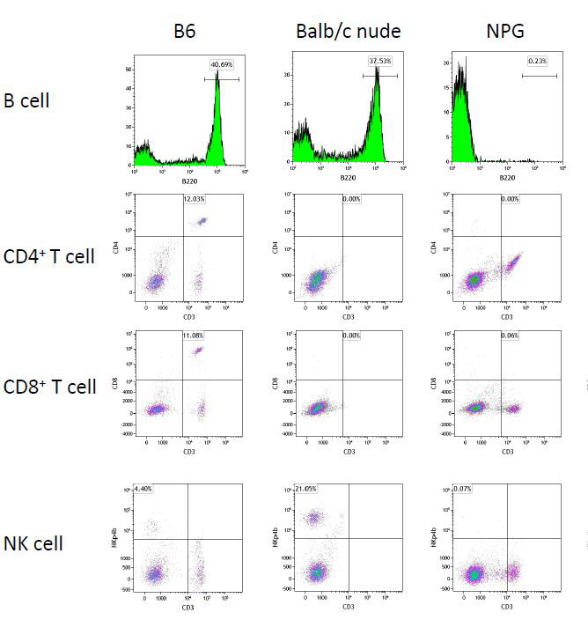
图6. B6, Balb/c nude和NPG小鼠外周血T、B和NK细胞检测
结果表明:经流式分析,与B6、Balb/c nude小鼠相比,NPG小鼠外周血CD3+CD4+和CD3+CD8+ T细胞、B220+ B细胞和NKp46+ NK细胞显著减少,几乎检测不到,说明NPG小鼠缺失有功能的T、B和NK细胞,免疫程度最重。
4. 免疫球蛋白分析
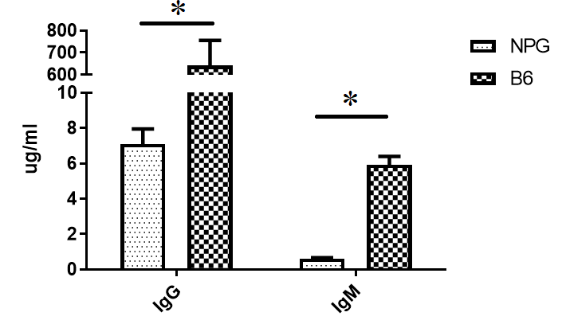
图7. B6和NPG小鼠外周血免疫球蛋白检测
结果表明:NPG小鼠外周血IgG与IgM含量显著低于B6小鼠。
5. 原位成瘤
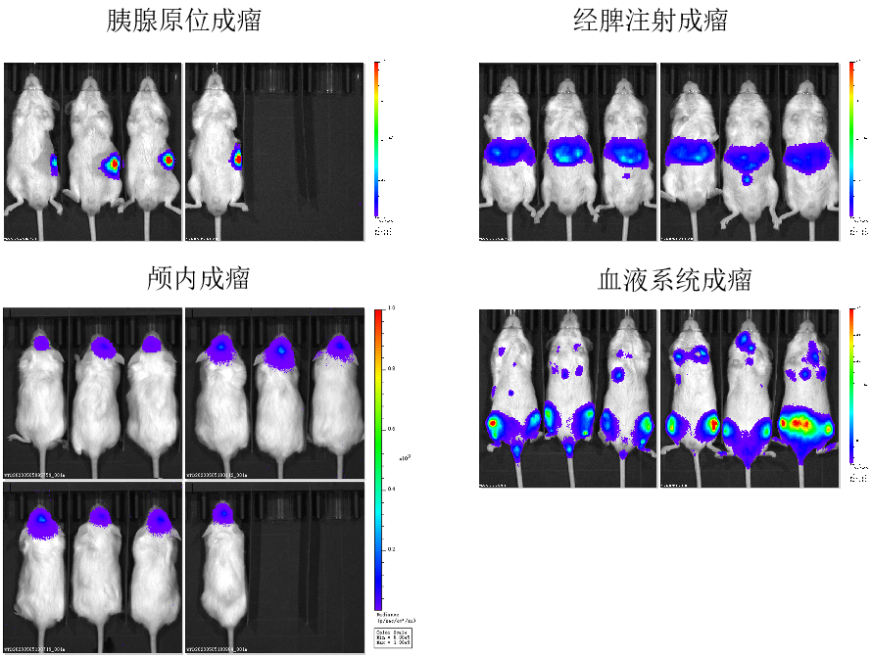
图8. NPG小鼠各器官原位成瘤示意图
6. 人造血干细胞(HSCs)移植重建效率与各免疫细胞重建水平
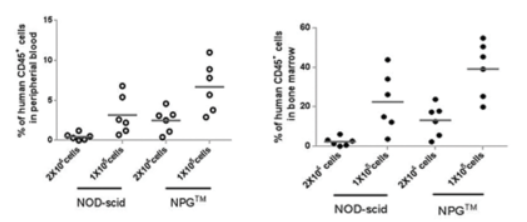
图9. NPG和NOD-scid小鼠移植人HSCs,第12周时hCD45+细胞嵌合率分析
结果表明:HSCs移植后,NPG小鼠的免疫重建效率显著高于NOD-scid小鼠。
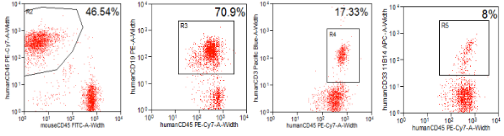
图10. 人HSCs移植NPG小鼠后获得各系造血细胞分化的高水平重建
结果表明:将5×104脐带血CD34+细胞移植16周后,在NPG小鼠外周血中检测到高水平的人CD45+细胞、CD19+ B细胞、CD3+ T细胞和CD33+髓系细胞。
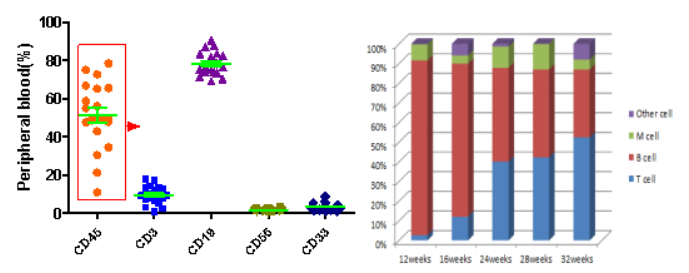
图11. 人HSCs移植NPG小鼠后各系细胞重建
结果表明:脐带血CD34+细胞移植NPG小鼠12周以及更长时间之后,人源造血细胞稳定重建,T细胞所占比例逐渐升高。
7. 外周血单个核细胞(PBMC)移植重建水平
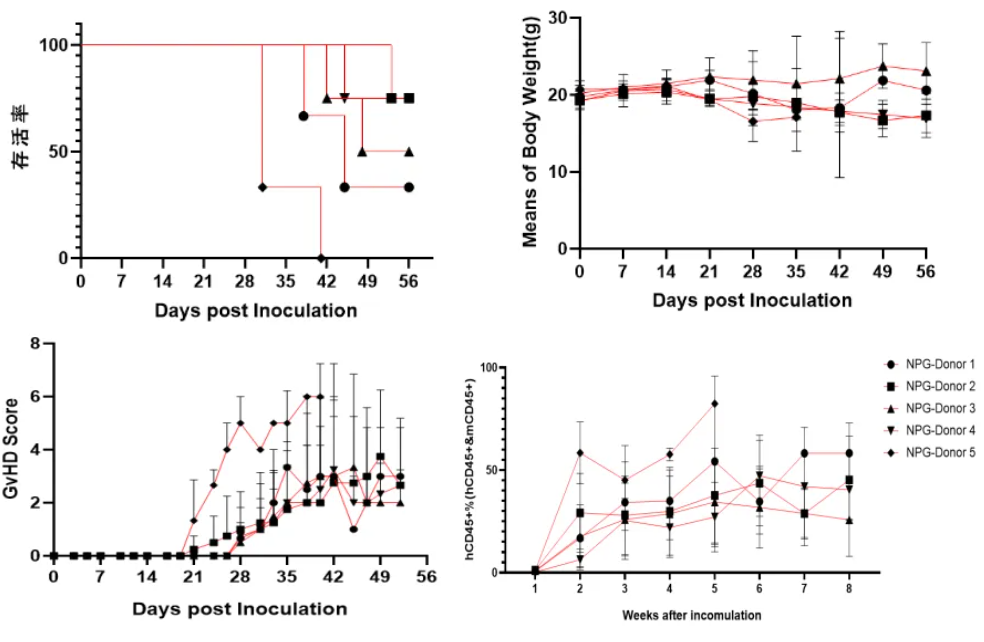
图12. 不同donor (5×106)来源的人PBMC移植后生存率、体重、GVHD评分及重建水平情况
NPG小鼠不同肿瘤造模及药效研究实例
1. 构建人淋巴瘤模型及CD7-CAR-T细胞治疗效果[1]
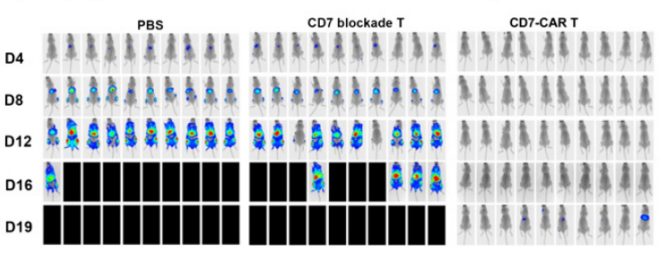
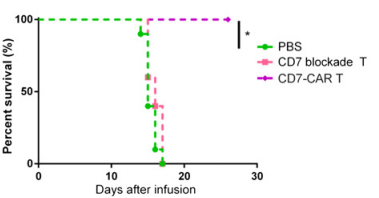
图13. CD7阻断CD7 CAR-T细胞在急性T淋巴细胞白血病肿瘤模型抗肿瘤作用
6-8周龄雌性NPG小鼠(n=10 per group)静脉注射1×105个Luc+ GFP+ CCRF-CEM细胞,5天后单次静脉注射5×108个细胞/kg的CD7阻断的CD7-CAR-T或CD7阻断的T细胞,PBS作为对照。结果表明:CD7阻断的CD7-CAR-T细胞延长了小鼠的中位生存期,显著缓解了白血病的进展。
2. 构建人肺腺癌模型及双抗药物药效[2]

A B
图14. Vγ2Vδ2 T细胞与双特异抗体Y111联合使用发挥抗肿瘤作用
6-8周龄雌性NPG(n=7 per group)在第0天皮下接种5´106 H1975细胞,15天后体积达到约220 mm3时分为4组,17天时静脉注射不同剂量(1 or 4 mg/kg)双特异性抗体Y111(PD-L1´CD3)联合标准化处理Vγ2Vδ2 T细胞(1´106),PBS作为对照组。在第20、24、27天时再次注射。结果表明:静脉注射Y111(4 mg/kg)联合标准化处理Vγ2Vδ2 T细胞可显著抑制NPG小鼠肿瘤生长。
3. 构建人前列腺癌模型及植物蛋白的抗肿瘤药效[3]
A B C
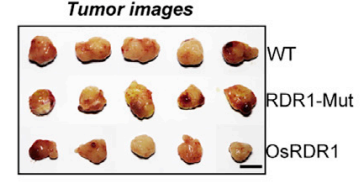
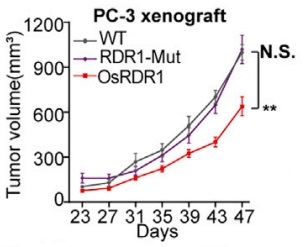
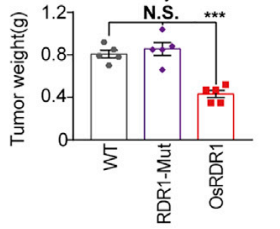
图15. 植物免疫球蛋白RDR1的肿瘤作用
4-6周龄雌性NPG(n=5 per group)在第0天腹部皮下接种RDR1诱导型2´106 PC-3细胞,并且通过Dox喂水以实现RDR1的异位表达,观测肿瘤生长状态。结果表明,野生型而非突变型RDR1显著抑制了所成肿瘤的大小、体积和重量。
4. 构建人胰腺癌模型及NK细胞治疗药效[4]
A B
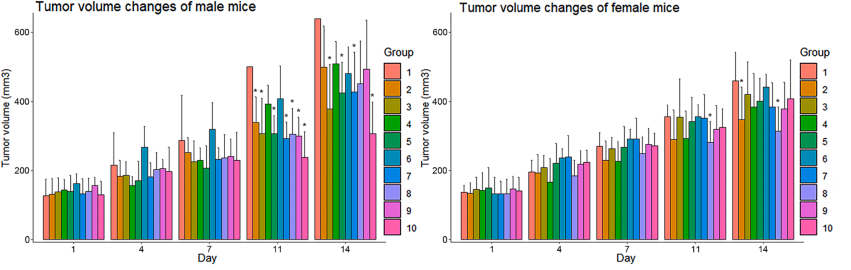
图16. NPG-CDX小鼠NK细胞治疗后肿瘤生长曲线
7-8周龄NPG小鼠(n=100,雌雄各50只)皮下注射0.2 mL对数生长期的BxPC-3细胞悬液(2.75×107 cell/mL;细胞活力为97%),建立皮下荷瘤小鼠异种移植模型。8天后按性别随机分10组,各组平均肿瘤体积为20-200 mm3,并于不同部位注射不同数量NK细胞。第1组小鼠静脉注射氯化钠作为载体对照,第2-4组小鼠静脉注射人外周血来源的NK细胞,第5-7组小鼠腹腔注射NK细胞,第8-10组小鼠瘤内注射NK细胞,观察治疗效果。结果表明:静脉注射是向携带人PaC的小鼠给予NK细胞的最安全方法,对肿瘤有明显的抑瘤效果。
5. 构建人结肠癌模型及CAR-T细胞治疗效果[5]
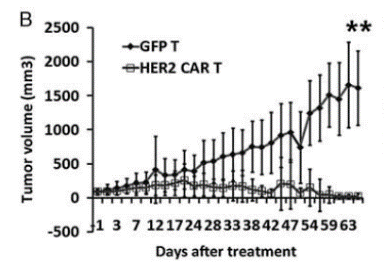
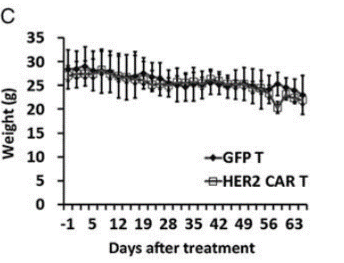
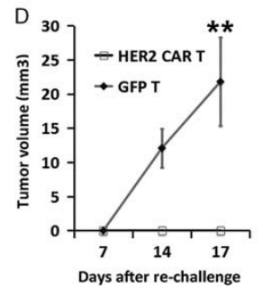
图17. NPG-PDX模型构建及HER2(人表皮生长因子受体2)特异性CAR-T细胞的抗肿瘤效果
6-10周龄NPG小鼠(n=6 per group)皮下接种来自结肠癌患者的肿瘤块(CRC),并在第7天和第14天输注5×106 T细胞。P1异种移植物肿瘤组织在第46天再次移植。本实验中使用的是P1代和P2代PDX模型,肿瘤体积达到50-100 mm3时,将2×106 GFP-T细胞或HER2特异
性CAR-T细胞静脉注射到荷瘤小鼠体内。结果表明:用HER2特异性T细胞处理的NPG-PDX小鼠2个月后肿瘤完全消除,体重生长参数与未处理的对照组没有显著差异。
6. 构建人源化小鼠人胃癌模型及PD-1抗体药治疗效果[6]

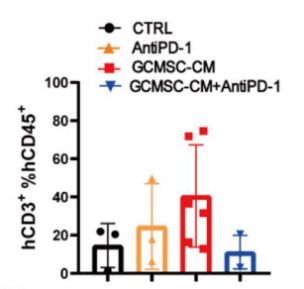
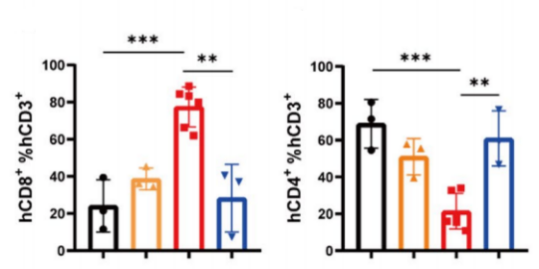
A B C D
图18. NPG移植人脐带血CD34+后接种患者胃癌肿瘤及肿瘤组织免疫细胞水平
4-8周龄NPG小鼠经X射线(1.2 Gy)照射后24 h内静脉注射5×104人脐带血CD34+细胞。重建12周之后接种胃癌细胞系,并分别或联合使用GCMSC-CM和PD-1抗体治疗并观测肿瘤变化,并检测不同处理组肿瘤组织中CD45+CD3+, CD3+CD8+, CD3+CD4+含量。结果表明:在治疗后21天,PD-1抗体治疗显著抑制胃肿瘤生长,而GCMSC-CM联合PD-1抗体比单独使用PD-1抗体治疗显著增加肿瘤体积,说明GCMSC-CM消除了PD-1抗体对胃肿瘤生长的抑制作用。
7. 构建人源化小鼠人多发性骨髓瘤模型及药效研究
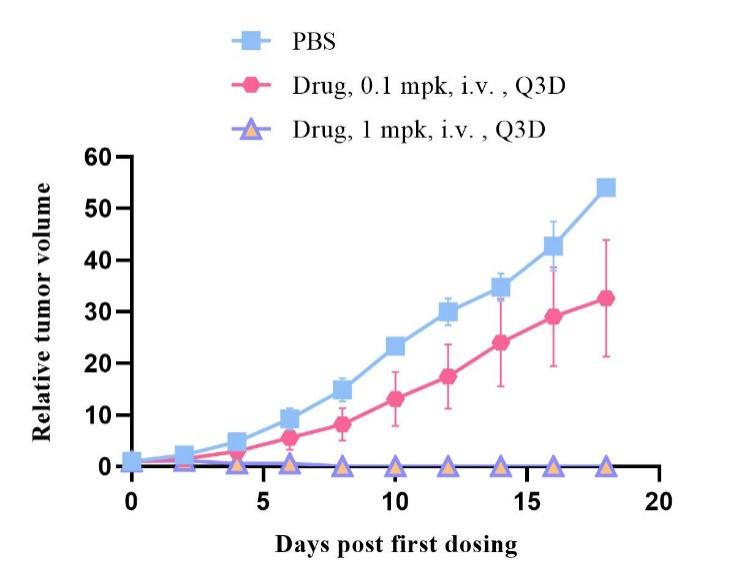
图19. PBMC-NPG小鼠人多发性骨髓瘤及药效
6周龄NPG小鼠移植5×106人PBMC,1周后皮下注射H929人多发性骨髓瘤,之后尾静脉注射不同剂量药物进行治疗研究,给药频率为三天一次,同时观测治疗效果。结果表明:药物(1 mpk剂量)对肿瘤的抑制效果显著。
NPG小鼠应用领域
1. 人源细胞或组织移植(如人结肠癌组织)
2. 肿瘤和肿瘤干细胞研究(如人淋巴瘤,人胰腺癌)
3. ES和iPS细胞研究
4. 造血和免疫学研究
5. 人类疾病感染模型研究(如HIV感染)
6. 人源化动物模型研发
参考文献
1. Zhang M, et al. Autologous Nanobody-Derived Fratricide-Resistant CD7-CAR T-cell Therapy for Patients with Relapsed and Refractory T-cell Acute Lymphoblastic Leukemia/Lymphoma. Clin Cancer Res. 2022, 28(13):2830-2843.
2. Yang R, et al. Bispecific Antibody PD-L1 x CD3 Boosts the Anti-Tumor Potency of the Expanded Vγ2Vδ2 T Cells. Front Immunol. 2021,12:654080.
3. Qi Y, et al. A plant immune protein enables broad antitumor response by rescuing microRNA deficiency. Cell. 2022, 185(11):1888-1904.e24.
4. Huang L, et al. Acute toxicities of intravenous, intraperitoneal, or intratumoral injection of natural killer cells in human pancreatic adenocarcinoma-bearing mice: Randomized study. Int Immunopharmacol. 2023, 124(Pt A):110881.
5. Teng R, et al. Chimeric Antigen Receptor-modified T Cells Repressed Solid Tumors and Their Relapse in an Established Patient-derived Colon Carcinoma Xenograft Model. J Immunother. 2019, 42(2):33-42.
6. Huang C, et al. Gastric cancer mesenchymal stem cells via the CXCR2/HK2/PD-L1 pathway mediate immunosuppression. Gastric Cancer. 2023, 26(5):691-707.