基本信息
品系名称 | Hu-URG |
来源 | 北京维通达生物技术有限公司 |
背景 | NOD |
毛色 | 白色 |
品系建立
将人的原代肝细胞移植到doxycycline(Dox)诱导的URG®小鼠肝脏中,即获得人源化肝脏小鼠(Hu-URG)。
Hu-URG小鼠由4种基因修饰动物模型交配获得,包含2个转基因和2个基因敲除。构建方式如下:
首先,TRE-uPA 转基因小鼠与 Alb-rtTA 转基因小鼠交配获得Alb-rtTA/TRE-uPA 双阳性小鼠,通过 Dox 诱导,在该小鼠中检测到了uPA 表达和肝损伤[1];其次,Alb-rtTA/TRE-uPA双阳性小鼠连续8代回交到NRG(NOD背景的Rag2nullIl2rgnull小鼠) 背景,获得Alb-rtTA/TRE-uPA/Rag2null/Il2rgnull小鼠(URG®);最后,将人的原代肝细胞移植到Dox诱导的URG®小鼠肝脏中,即获得人源化肝脏小鼠Hu-URG®,移植窗口期不受限制。
Hu-URG®不诱导时 uPA并不表达,小鼠健康生长;当用Dox诱导时,Tet-On系统驱动的uPA 即在肝内表达,小鼠出现肝损伤。作为新一代的可调控肝损伤人源化肝脏小鼠模型[2-6],人源肝脏细胞可以实现20-95%整肝重建。
表型信息
1. 外周血相关蛋白及血脂检测
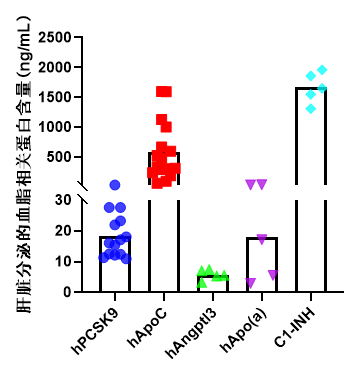
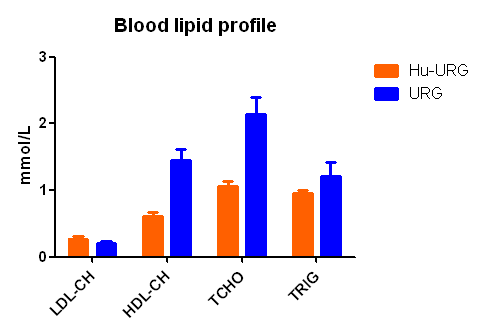
图1. Hu-URG®小鼠外周相关蛋白及血脂检测
2. 人肝细胞重建水平
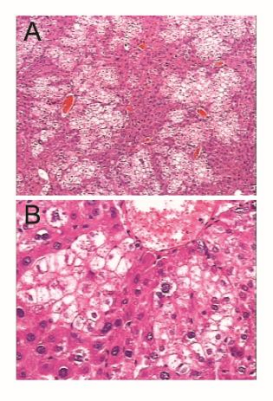
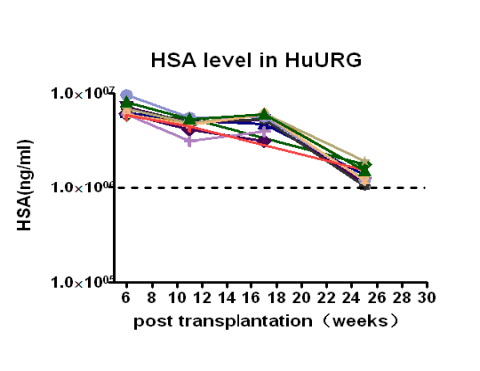
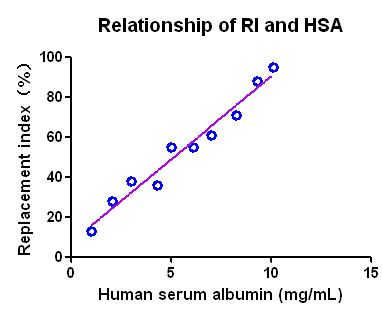
C D
图2. Hu-URG®小鼠人肝细胞重建
注:(A,B) HE 染色证明人肝细胞在 Hu-URG®小鼠肝脏中重建成功,染色浅的部分为人肝脏细胞;(C) Hu-URG®的外周血人Alb 水平;(D) Hu-URG®外周血Alb水平与人肝细胞嵌合程度相关性分析
3. 肝脏五叶区人肝细胞嵌合分析
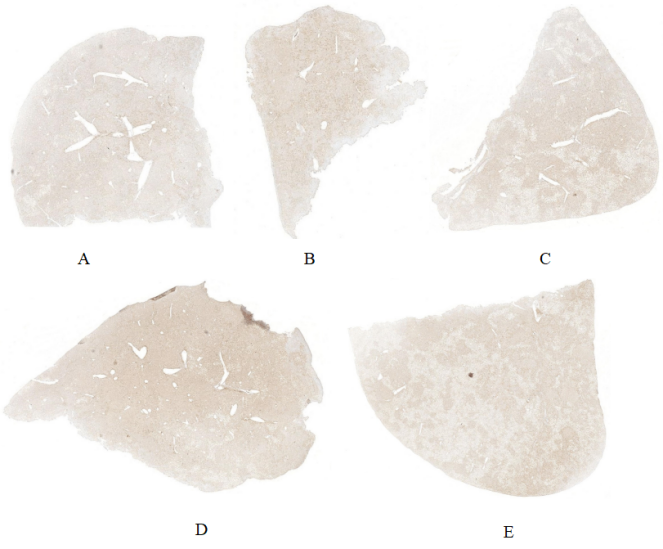
图3. Hu-URG®小鼠肝脏五叶区人肝细胞嵌合分析
Hu-URG®小鼠不同肝叶的人白蛋白抗体免疫组化染色显示,人肝细胞均匀嵌合于肝脏五个叶区。
4. 肝脏人源肝细胞特有基因与蛋白表达分析
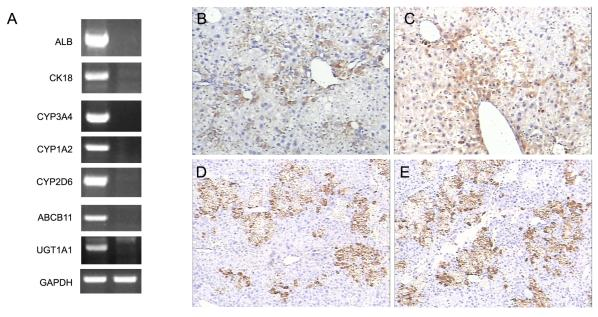
图4. Hu-URG®小鼠构建成功6周后肝脏组织检测分析
注:(A)肝qRT-PCR 分析表达人特异的基因;(B,C,D,E)人 Albumin, CK18, CYP3A4, CYP1A2免疫组化染色阳性
5. 感染人类专嗜的乙肝病毒(HBV)
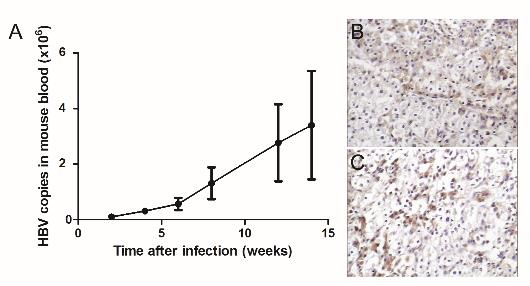
图5. Hu-URG®小鼠支持人HBV病毒感染
Hu-URG®小鼠血清中HBV病毒滴度随感染时间延长逐渐升高,证明HBV病毒在模型内复制,同时进行染色发现HBV表面抗原和核心抗原染色阳性。
6. Hu-URG®小鼠药物代谢和药物相互作用的体内研究
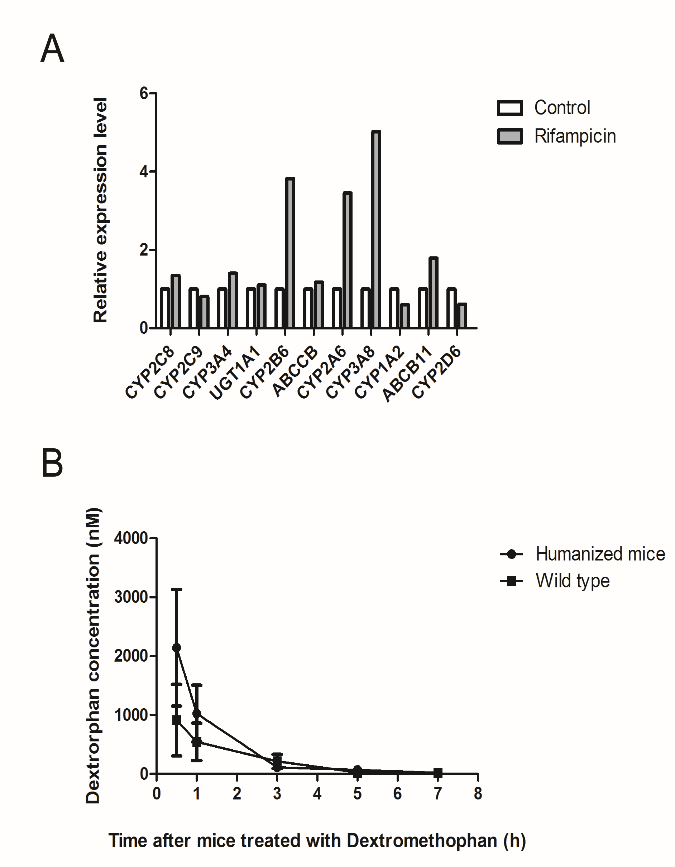
图6. 药物在Hu-URG®小鼠肝脏中的代谢更接近人类
注:(A)利福平在Hu-URG®小鼠肝脏中诱导P450家族CYP酶和转运体蛋白的升高;(B)Dextromethophan在Hu-URG小鼠更快地代谢成dextrophan.
Hu-URG®小鼠感染HBV及药效研究实例
1. Hu-URG®用于研究HBV患者血清感染后小分子化合物抗病毒活性及其对cccDNA转录的潜在影响机制[7]
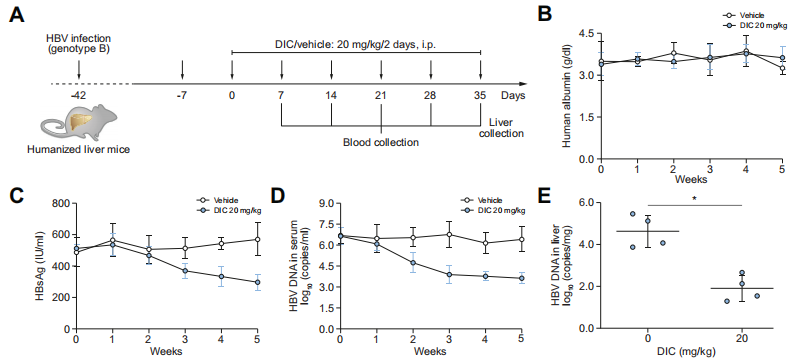
图7. Dicoumarol对HBV感染Hu-URG®小鼠的抗病毒活性
Hu-URG®小鼠(n=4/group)静脉注射50 μL HBV患者血清(基因型 B, 5.12×106 copies/mL)。6周后,每隔一天腹腔注射20 mg/kg Dicoumarol,同时设置对照组。每周眼眶静脉窦取血。给药35 d后处死小鼠,收集肝脏组织进行分析。结果表明:Hu-URG小鼠血清中Alb一直处于较高水平。在给药Dicoumarol治疗的5周内高于3 mg/mL,与对照组无显著差异。Dicoumarol 处理可有效降低血清 HBsAg和HBV DNA水平,并降低肝内HBV DNA和HBV RNAs水平。
2. Hu-URG®小鼠用于研究培养的HBV病毒颗粒感染后化合物抗病毒活性及其对cccDNA转录影响[8]
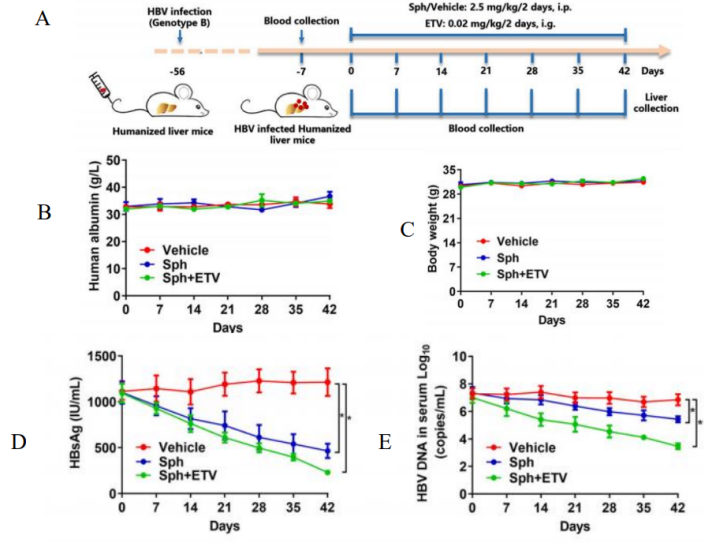
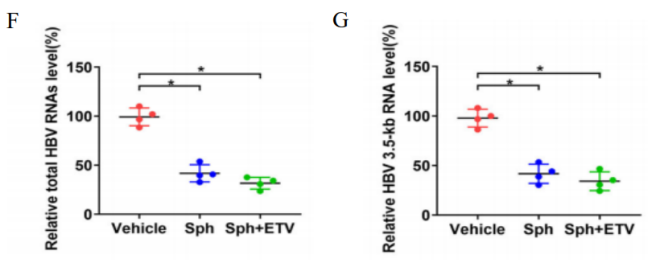
图8. Sphondin对HBV感染Hu-URG小鼠的抗病毒活性
Hu-URG®小鼠(n=4/group)静脉注射患者血清(基因型B)。8周后,将小鼠随机分为对照组、sphondin单药治疗组和ETV+sphondin 联合组,按照如图设计给药取材。结果表明:Hu-URG®小鼠血清中人Alb一直处于较高水平。在单独或联合给药治疗的6周内高于3 mg/mL,与对照组无显著差异。给药处理对体重也无显著影响。sphondin治疗可使血清 HBsAg和HBV DNA显著降低。同样也能显著降低肝内总HBV RNA、3.5 kb RNA、HBsAg和HBx蛋白水平。
3. Hu-URG®用于研究HBx通过DDB1介导的WDR77在肝脏中的降解增强HBV复制[9]
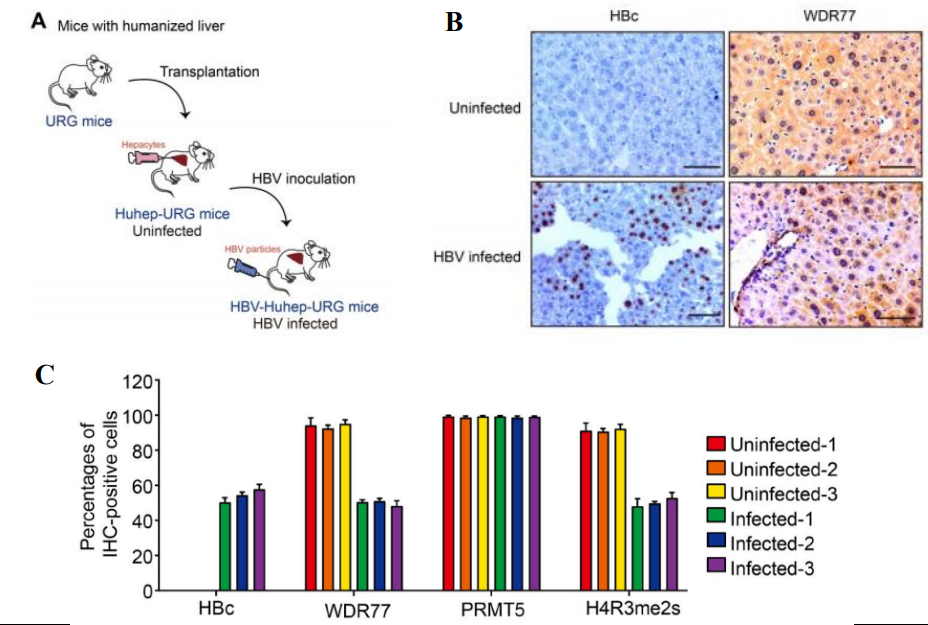

图9. HBV感染导致WDR77水平下降
PHHs通过脾内注射至3周龄URG®小鼠中(n=3/group),ELISA法测定血清人Alb,评估PHHs的植入和活力。然后用2.5×108 IU/mL (0.2 mL/只)HBV颗粒感染小鼠,8周后处死小鼠。结果表明:Hu-URG®小鼠血清中Alb处于较高水平且可正常感染HBV,HBV感染和HBx表达显著降低了Hu-URG®的WDR77的蛋白水平,进而限制cccDNA转录和HBV复制。
4. Hu-URG®用于研究药物治疗慢性乙肝的潜在靶点[10]
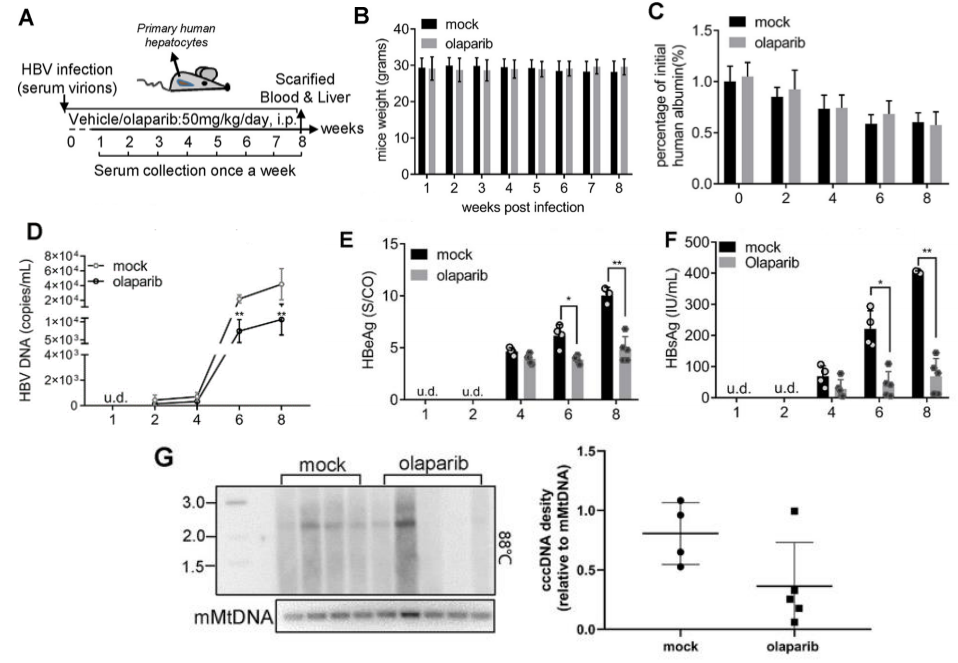
图10. PARP1抑制剂(olaparib)处理的 Hu-URG®小鼠HBV cccDNA 减少
9只雄性小鼠(n=4 male mice in mock group, n=5 male mice in olaparib group)静脉注射 HBV患者血清50 μL (5×108 copies/mL)。在HBV感染12小时后以每天50 mg/kg的剂量腹腔给药稀释的PARP1抑制剂olaparib。结果表明:Hu-URG®在DMSO组和olaparib组的体重和血清人Alb水平无显著差异。给药后导致血清HBV DNA、HBsAg和HBeAg水平显著降低。肝内HBV cccDNA水平降低一半。这些数据表明olaparib可减少体内HBV复制和cccDNA的形成。
5. Hu-URG®用于研究IFN-α介导HDAC3抑制HBV转录和复制的通路研究[11]
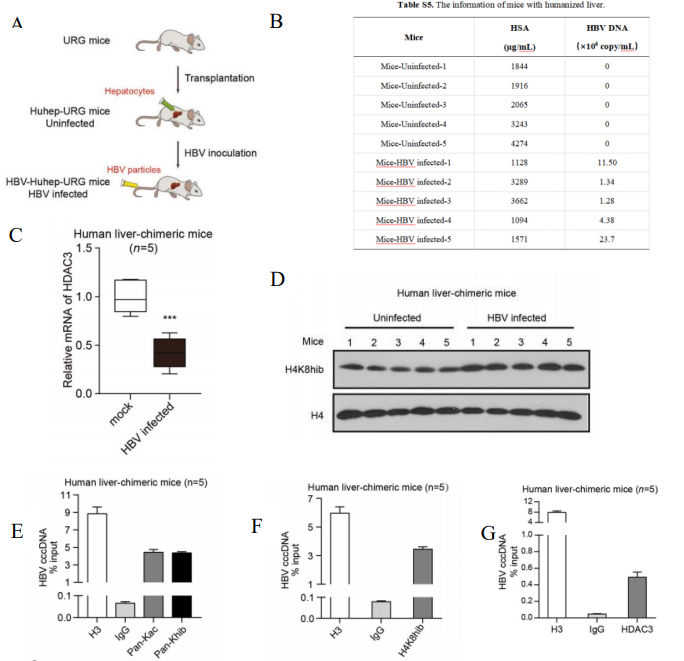
图11. IFN-α介导HDAC3抑制HBV的转录和复制
原代人肝细胞(PHH)移植到3周龄(n=5 each group, male and female)URG®小鼠,构建产生Hu-URG®小鼠。然后用来自HepAD38细胞上清液5.0×108 IU/mL (0.2mL/小鼠)HBV颗粒进行感染Hu-URG®小鼠。结果表明:人肝嵌合小鼠血清中Alb处于较高水平且可正常感染 HBV,感染HBV的Hu-URG®小鼠中的HDAC3 mRNA水平较对照组显著降低,Western blot分析证实组蛋白H4K8 2-羟基异丁酰化水平明显增强。ChIP分析显示,HDAC3与HBV感染的Hu-URG®小鼠肝脏中的HBV cccDNA结合,这表明HDAC3锚定在HBV cccDNA染色体上。本研究发现IFN-α通过促进HDAC3介导的肝脏HBV cccDNA染色体上组蛋白H4K8的去2-羟基异丁酰化来抑制HBV转录和复制。
Hu-URG®小鼠应用领域
1. Hu-URG®小鼠可用于人特异的肝病、药物安全性评估和人特异的肝脏代谢酶相关的研究
2. HBV,HCV感染及抗病毒活性信号通路研究
3. 药物代谢与药代动力学、药效研究
4. 干细胞研究
5. 基因治疗
参考文献
1. Song X J, et al. A Mouse Model of Inducible Liver Injury Caused by Tet-On Regulated Urokinase for Studies of Hepatocyte Transplantation. Am J Pathol. 2009, 175(5):1975-1983.
2. Du Y, et al. Human hepatocytes with drug metabolic function induced from fibroblasts by lineage reprogramming. Cell Stem Cell. 2014, 14(3):394-403.
3. Azuma, H. et al. Robust expansion of human hepatocytes in Fah-/-/Rag2-/-/Il2rg-/- mice. Nat Biotechnol. 2007, 25(8):903-910.
4. Bissig KD, et al. Human liver chimeric mice provide a model for hepatitis B and C virus infection and treatment. J Clin Invest. 2010, 120(3):924-930.
5. Xu D, et al. Chimeric TK-NOG mice: a predictive model for cholestatic human liver toxicity. J Pharmacol Exp Ther. 2015, 352(2):274-280.
6. Foquet L, et al. Successful Engraftment of Human Hepatocytes in uPA-SCID and FRG® KO Mice. Methods Mol Biol. 2017, 1506:117-130.
7. Cheng ST, et al. Dicoumarol, an NQO1 inhibitor, blocks cccDNA transcription by promoting degradation of HBx. J Hepatol. 2021, 74:522-534.
8. Ren F, et al. Sphondin efficiently blocks HBsAg production and cccDNA transcription through promoting HBx degradation. J Med Virol. 2023, 95:e28578.
9. Yuan H, et al. HBx represses WDR77 to enhance HBV replication by DDB1-mediated WDR77 degradation in the liver. Theranostics. 2021, 11(17):8362-8378.
10. Chen Y, et al. DNA Repair Factor Poly (ADP-Ribose) Polymerase 1 Is a Proviral Factor in Hepatitis B Virus Covalently Closed Circular DNA Formation. J Virol. 2022, 96(13):e0058522.
11. Zhao LN, et al. IFN-α inhibits HBV transcription and replication by promoting HDAC3-mediated de-2-hydroxyisobutyrylation of histone H4K8 on HBV cccDNA minichromosome in liver. Acta Pharmacol Sin. 2022, 43(6):1484-1494.