细胞与基因治疗
异种移植模型(xenograft model)在细胞与基因治疗中的研究中具有重要意义,特别是在筛选候选药物、评估新疗法、以及加速药物开发方面。异种移植模型通常涉及将人类细胞或组织移植到免疫缺陷小鼠中,以便在体内研究这些人类细胞或组织的行为和治疗反应。在异种移植模型验证细胞与基因治疗为新疗法的临床实验提供了有价值的参考。尽管存在技术挑战和一些限制,但这些模型在推动再生医学、癌症研究和个性化治疗方面具有巨大潜力。通过合理设计实验和综合应用多种模型,可以获得具有临床相关性的研究结果,为未来治疗策略的开发提供重要依据。
我们维通达利用高度免疫缺陷小鼠建立的异源移植模型CDX或者PDX已验证多种细胞与基因治疗的疗效,涉及动物包含NPG、HSC-NPG、PBMC-NPG、PBMC-DK-NPG、HSC-GM3-NPG等小鼠以及F344RG大鼠。下面列举几种典型例子。
1. NPG-CDX小鼠NK细胞治疗[1]
A B
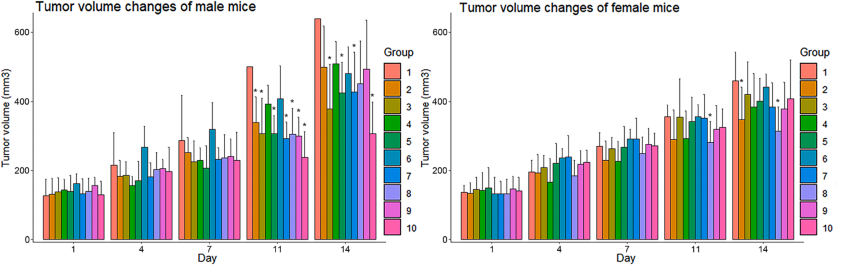
图1. NPG-CDX小鼠NK细胞治疗后肿瘤生长曲线
7-8周龄NPG小鼠(n=100,雌雄各50只)皮下注射0.2 mL对数生长期的BxPC-3细胞悬液(2.75×107 cell/mL;细胞活力为97%),建立皮下荷瘤小鼠异种移植模型。8天后按性别随机分10组,各组平均肿瘤体积为20-200 mm3,并于不同部位注射不同数量NK细胞。第1组小鼠静脉注射氯化钠作为载体对照,第2-4组小鼠静脉注射人外周血来源的NK细胞,第5-7组小鼠腹腔注射NK细胞,第8-10组小鼠瘤内注射NK细胞,观察治疗效果。结果表明:静脉注射是向携带人PaC的小鼠给予NK细胞的最安全方法,对肿瘤有明显的抑瘤效果。
2. NPG-PDX模型构建人结肠癌及HER2特异性CAR-T细胞治疗[2]
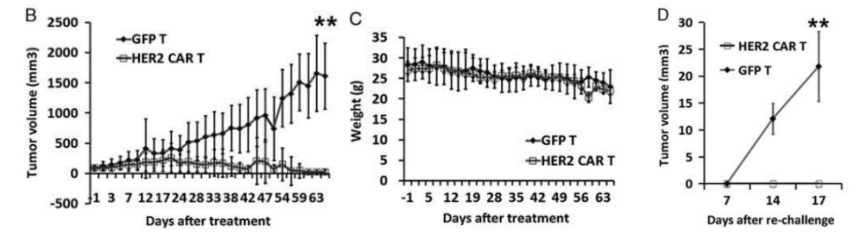
图2. NPG-PDX模型构建及HER2(人表皮生长因子受体2)特异性CAR-T细胞的抗肿瘤效果
6-10周龄NPG小鼠(n=6 per group)皮下接种来自结肠癌患者的肿瘤块(CRC),并在第7天和第14天输注5×106 T细胞。P1异种移植物肿瘤组织在第46天再次移植。本实验中使用的是P1代和P2代PDX模型,肿瘤体积达到50-100 mm3时,将2×106 GFP-T细胞或HER2特异
性CAR-T细胞静脉注射到荷瘤小鼠体内。结果表明:用HER2特异性T细胞处理的NPG-PDX小鼠2个月后肿瘤完全消除,体重生长参数与未处理的对照组没有显著差异。
3. NPG-CDX模型构建人淋巴瘤及DKO CAR-T细胞基因治疗[3]
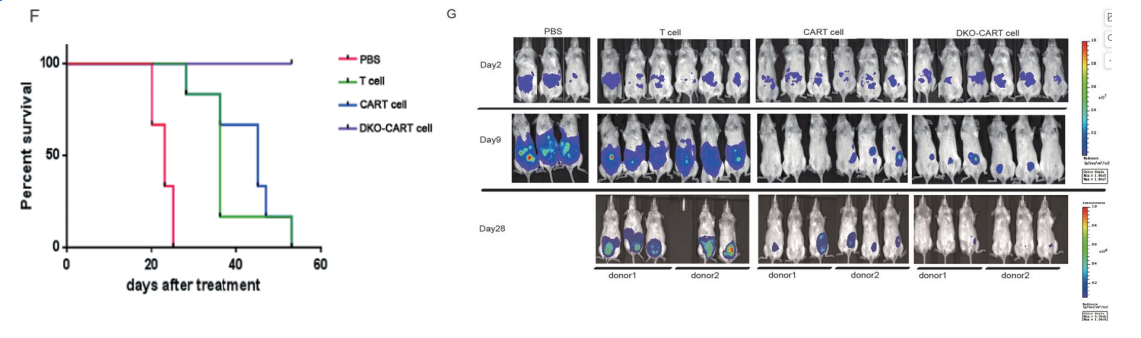
图3. NPG-CDX小鼠DKO CAR-T细胞基因治疗后肿瘤生长曲线
6-12周龄NPG小鼠腹腔注射2×105 Raji-ffluc细胞(人淋巴瘤)。2天后成像评估肿瘤移植情况。根据肿瘤负荷分组,1天后腹腔注射200 uL PBS、5×106 T细胞、5×106 CAR-T细胞、5×106 DKO CAR-T(TRAC/B2M敲除)细胞。观测各组别不同时间的抗肿瘤效果。结果表明:标准CAR-T细胞和DKO-CAR-T细胞治疗组的小鼠肿瘤较未修饰的T细胞或PBS组显著变小,存活时间也更长。
4. NPG-PDX模型构建人结直肠癌及CISR-CAR T细胞免疫疗法[4]
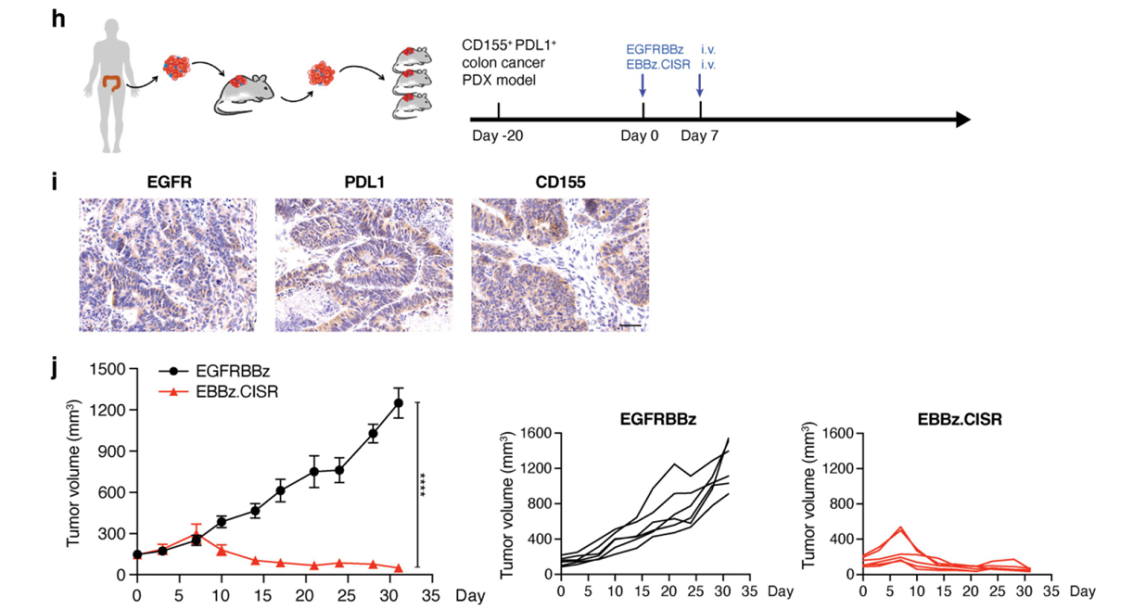
图4. NPG-PDX小鼠构建及CISR-CAR T细胞免疫疗法效果
结直肠癌PDX肿瘤组织皮下移植NPG小鼠(n=6 per group)。植入后约20天,当肿瘤体积达到100-200 mm3时,采用免疫组化染色法分析用于建立PDX模型的肿瘤组织中EGFR、PDL1、CD155的表达谱。小鼠接受两次静脉注射3×106 EGFRBBz-CAR - T细胞或EBBz.CISR T细胞,观测治疗效果。结果表明,建立起来的结直肠癌PDX模型可检测到标志物EGFR、PDL1、CD155,同时EBBz.CISR T细胞有显著的抑瘤效果。
参考文献:
1. Huang L, Lyu Z, Yang H, et al. Acute toxicities of intravenous, intraperitoneal, or intratumoral injection of natural killer cells in human pancreatic adenocarcinoma-bearing mice: Randomized study. Int Immunopharmacol. 2023, 124(Pt A):110881.
2. Teng R, Zhao J, Zhao Y, et al. Chimeric Antigen Receptor-modified T Cells Repressed Solid Tumors and Their Relapse in an Established Patient-derived Colon Carcinoma Xenograft Model. J Immunother. 2019, 42(2):33-42.
3. Liu X, Zhang Y, Cheng C, et al. CRISPR-Cas9-mediated multiplex gene editing in CAR-T cells. Cell Res. 2017, 27(1):154-157.
4. Zhao J, Dong J, Deng C, et al. Enhancing T cell anti-tumor efficacy with a PD1-TIGIT chimeric immune-checkpoint switch receptor. Oncoimmunology. 2023,12(1):2265703.