大小分子药物治疗
异源肿瘤移植模型在大分子药物研发中的应用具有重要的研究和临床价值。通过在这些模型中进行药效评估、安全性研究、肿瘤微环境研究、耐药机制研究和个性化医疗探索,可以加速大小分子药物的开发和临床转化,为癌症治疗提供新的选择和策略。这些模型为理解大小分子药物的作用机制、优化治疗方案以及提高治疗效果提供了重要的实验平台。
目前,北京维通达测试的大小分子药物药效服务已涵盖多种类型,包括单抗、双抗、融合蛋白、重组蛋白、疫苗、细胞治疗产品、基因治疗产品和干细胞疗法等。涉及动物包含NPG、HSC-NPG、PBMC-NPG、PBMC-DK-NPG、HSC-GM3-NPG等小鼠以及F344RG大鼠。其中F344RG大鼠是维通达自主研发的高度免疫缺陷大鼠,因其较大体型使其肿瘤样本负荷量大,可获取更多的肿瘤样本;同时较大体型使其具有更大循环血容量,实现高频次取血、更多血液样本,同时减少动物数量,提高数据一致性;降低外科操作难度(原位癌)等。众多优点于一体使得F344RG大鼠是一种适用于药效学评价(抗肿瘤药物、心血管药物、代谢病研究等)、安全性评价(急性或慢性毒性、致癌性、生殖和发育毒性、免疫毒性研究等)、药代学评价(吸收、分布、动力学研究等)的很好模型。下面列举一些单抗、双抗、蛋白分子的实用案例。
1. HSC-NPG-CDX胃癌模型及PD-1抗体药物治疗[1]
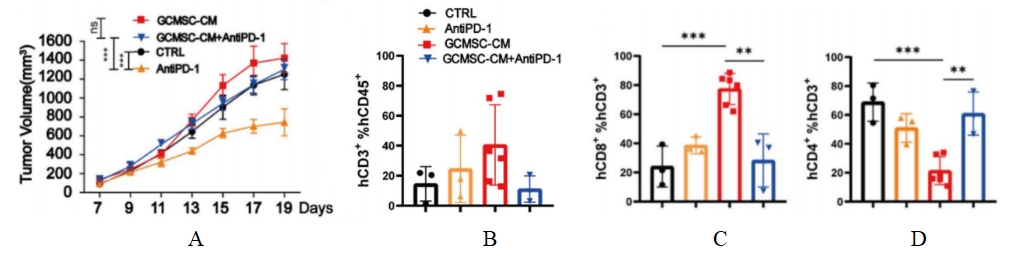
图1. NPG移植人脐带血CD34+后接种患者胃癌肿瘤及肿瘤组织免疫细胞水平
4-8周龄NPG小鼠经X射线(1.2 Gy)照射后24 h内静脉注射5×104人脐带血CD34+细胞。重建12周之后接种胃癌细胞系,并分别或联合使用GCMSC-CM和PD-1抗体治疗并观测肿瘤变化,并检测不同处理组肿瘤组织中CD45+CD3+, CD3+CD8+, CD3+CD4+含量。结果表明:在治疗后21天,PD-1抗体治疗显著抑制胃肿瘤生长,而GCMSC-CM联合PD-1抗体比单独使用PD-1抗体治疗显著增加肿瘤体积,说明GCMSC-CM消除了PD-1抗体对胃肿瘤生长的抑制作用。
2. NPG-CDX肺腺癌模型及PD-L1×CD3双抗药物治疗[2]
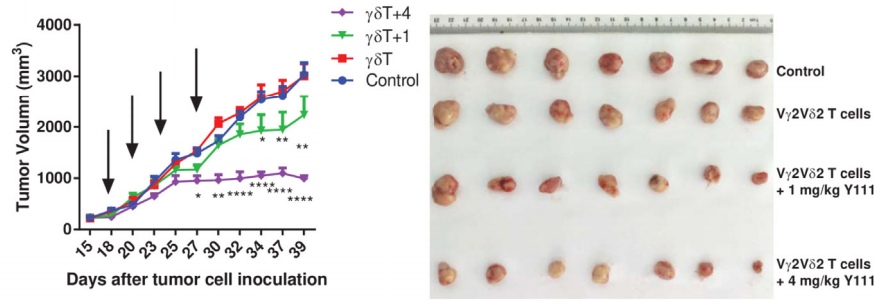
A B
图2. Vγ2Vδ2 T细胞与双特异抗体Y111联合使用发挥抗肿瘤作用
6-8周龄雌性NPG(n=7 per group)在第0天皮下接种5×106 H1975细胞,15天后体积达到约220 mm3时分为4组,17天时静脉注射不同剂量(1 or 4 mg/kg)双特异性抗体Y111(PD-L1×CD3)联合标准化处理Vγ2Vδ2 T细胞(1×106),PBS作为对照组。在第20、24、27天时再次注射。结果表明:静脉注射Y111(4 mg/kg)联合标准化处理Vγ2Vδ2 T细胞可显著抑制NPG小鼠肿瘤生长。
3. NPG-CDX人前列腺癌模型及植物蛋白的抗肿瘤药效[3]
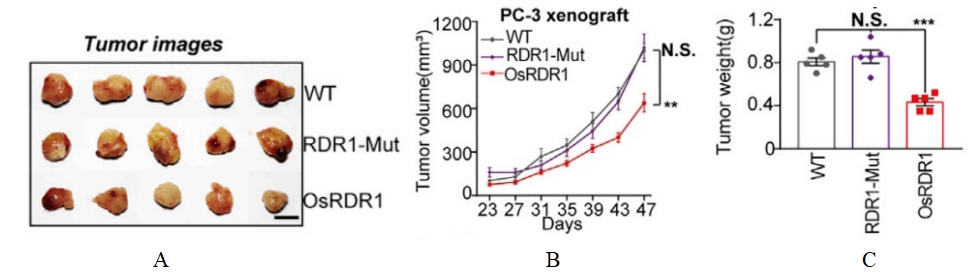
图3. 植物免疫球蛋白RDR1的肿瘤作用
4-6周龄雌性NPG(n=5 per group)在第0天腹部皮下接种RDR1诱导型2×106 PC-3细胞,并且通过Dox喂水以实现RDR1的异位表达,观测肿瘤生长状态。结果表明,野生型而非突变型RDR1显著抑制了所成肿瘤的大小、体积和重量。
4. F344RG大鼠的CDX人脑胶质瘤的CAR-T药物测试
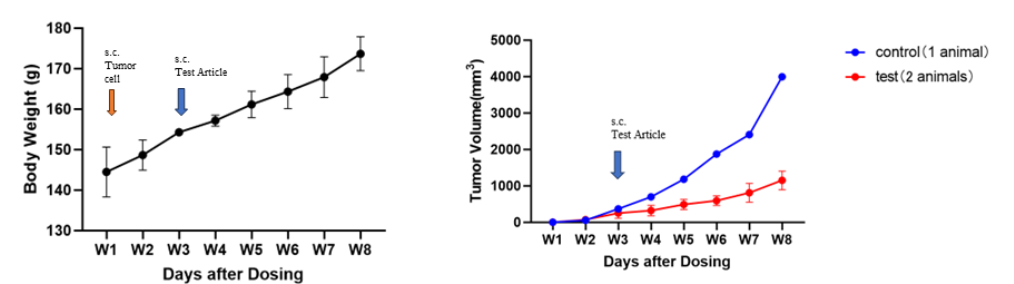
图4. CAR-T测试药物对脑胶质瘤的抑瘤效果
参考文献:
1. Huang C, Chen B, Wang X, et al. Gastric cancer mesenchymal stem cells via the CXCR2/HK2/PD-L1 pathway mediate immunosuppression. Gastric Cancer. 2023, 26(5):691-707.
2. Yang R, Shen S, Gong C, et al. Bispecific Antibody PD-L1 x CD3 Boosts the Anti-Tumor Potency of the Expanded Vγ2Vδ2 T Cells. Front Immunol. 2021,12:654080.
3. Qi Y, Ding L, Zhang S, et al. A plant immune protein enables broad antitumor response by rescuing microRNA deficiency. Cell. 2022, 185(11):1888-1904.e24.